Электроотрицательность. Виды химических связей
Начнем с того, почему вообще важна электроотрицательность. Все химические связи образуются за счет нее. В зависимости от того, какие атомы вступают в образование химической связи, она делится на определенные виды. Поэтому для того, чтобы понять суть этого деления, нам нужно разобраться:
- Что такое электроотрицательность.
- Как она формируется и от чего зависит.
Для того чтобы понять это, нам понадобится понятие атомного остова из прошлой статьи.
Электроотрицательность
Электроотрицательность — это способность атома оттягивать на себя электроны с внешнего электронного слоя.
Да-да, ЕГЭ вы сдали хорошо — электроотрицательность увеличивается слева направо и сверху вниз, но почему? Выделим две причины, но для второй нам потребуется немного физики. Ну все, ты закрываешь статью и говоришь: «Какая физика?»
- Чем меньше электронов нужно принять для завершения слоя, тем проще их присоединить, так как они будут меньше отталкивать друг друга. Одноименные заряды отталкиваются. Зачем я это написал, ты ведь и так это знаешь…
- Сила притяжения электрона к ядру и радиус атома. Радиус атома в одном периоде плюс-минус одинаковый, но вот сила притяжения электрона к ядру слева направо увеличивается. Мы построим небольшую модельку. Пусть она и не совсем верная, но даст понимание вещей.
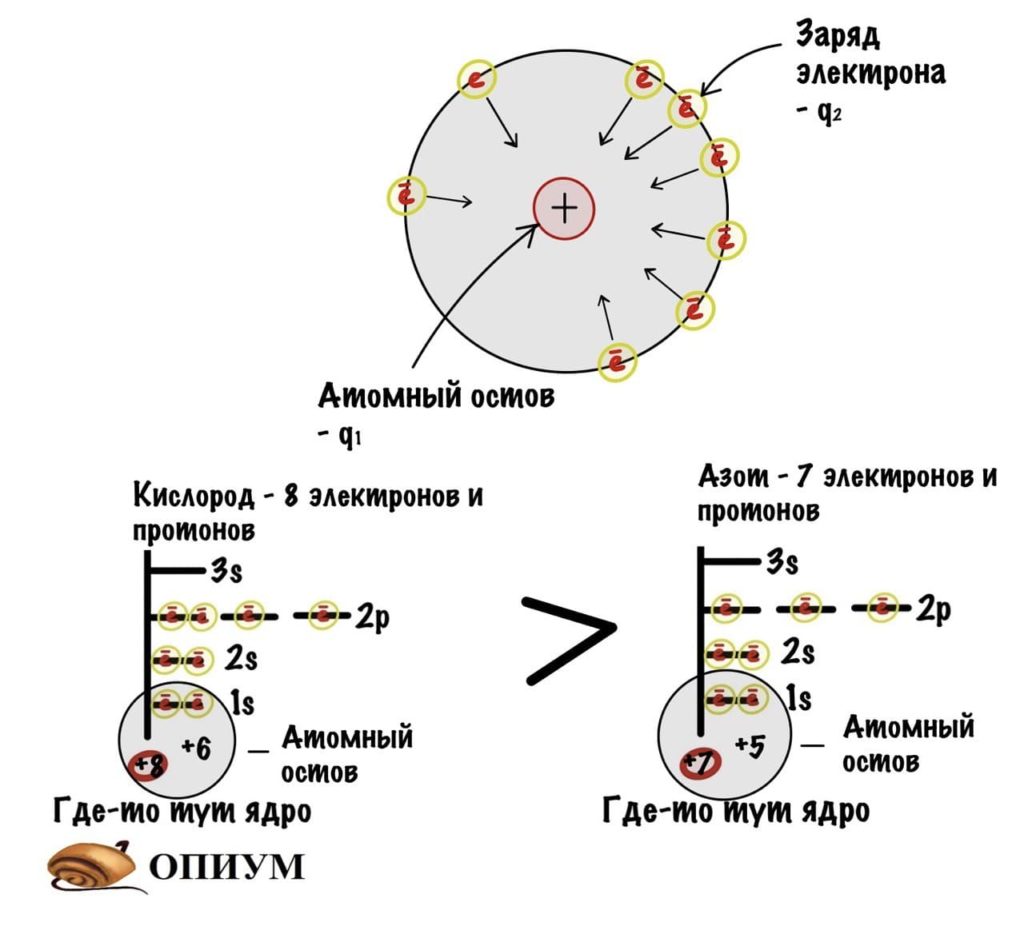
Так, начнем с закона Кулона — он показывает силу взаимодействия между двумя электрическими зарядами. Наши заряды разноименные. Атомный остов — положительный, а электрон — отрицательный. Значит они притягиваются друг к другу.
Сразу скажу, что ничего считать мы не будем. Коэффициент — k нас не интересует. Нам просто нужно понять, что чем больше q1 и q2, тем больше сила притяжения между зарядами. Радиус, как я писал до этого, примерно одинаковый в одном периоде. Теперь мы можем сравнить электроотрицательность атомов второго периода с помощью небольшого рисунка. Для этого мы предположим, что электроны находятся примерно на одном расстоянии атомного остова.
Получается, что q1 — это заряд атомного остова, а q2 — заряд электрона, который всегда одинаковый. Вот мы и нашли легкую зависимость — чем больше заряд атомного остова, тем с большей силой он притягивает электрон, и тем больше электроотрицательность. У кислорода заряд ядерного остова 6, а у азота только 5. Самый большой заряд у фтора — 7. С увеличением периода возрастает радиус атома — электроотрицательность становится меньше. Получается, что максимальная электроотрицательность у элементов второго периода и растет она слева направо, так как увеличивается заряд атомного остова.. Хоть мы это и знали, но прикольно же понять почему такое происходит?
Виды химических связей
Напишу про все, кроме металлической связи, она не особо интересует нас в биохимии. Химическая связь нужна для того, чтобы придать дополнительную стабильность системе. Что за система? Ну это просто атомы, которые вступают в образование связей — при образовании связи энергия системы уменьшается, и она становится стабильнее, а значит стабильнее и состояние атома.
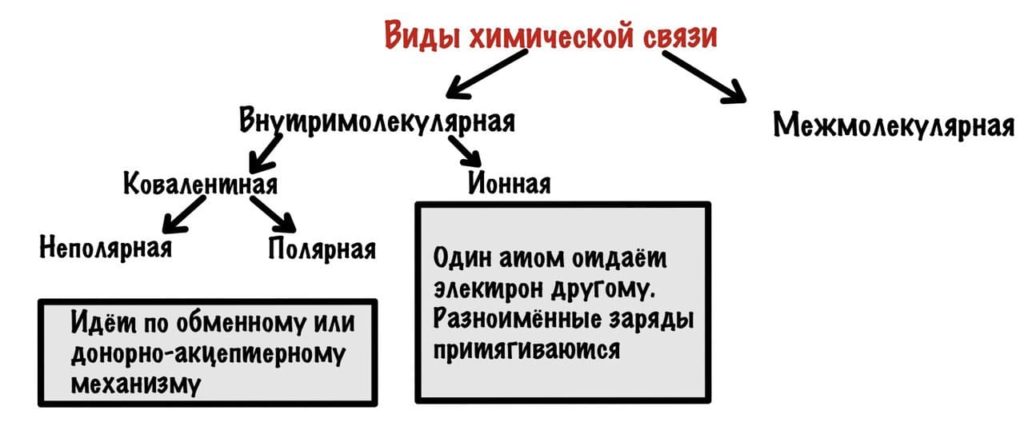
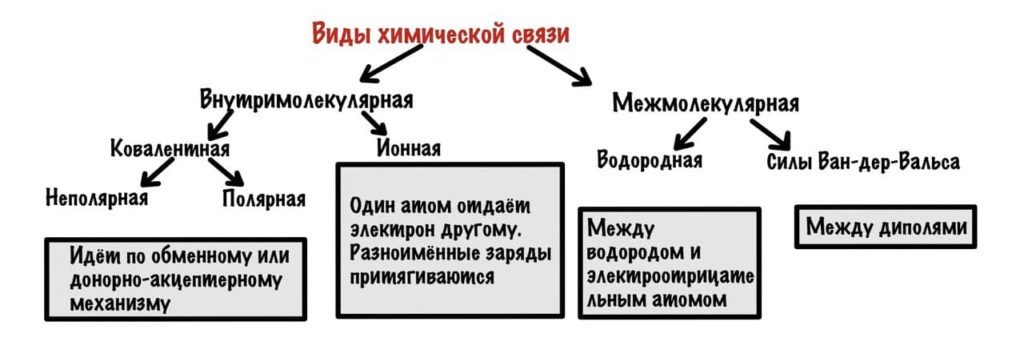
Можно разделить химические связи на две группы: внутримолекулярные и межмолекулярные. Начнем с внутримолекулярных.
Внутримолекулярные химические связи
Всего два варианта: ионная и ковалентная. Правда последняя делится на две, но разберемся с этим в процессе.
Ковалентная химическая связь
Она возникает, если атомы образуют общие электронные пары. Может идти по двум механизмам: обменному и донорно-акцептерному.
Обменный механизм
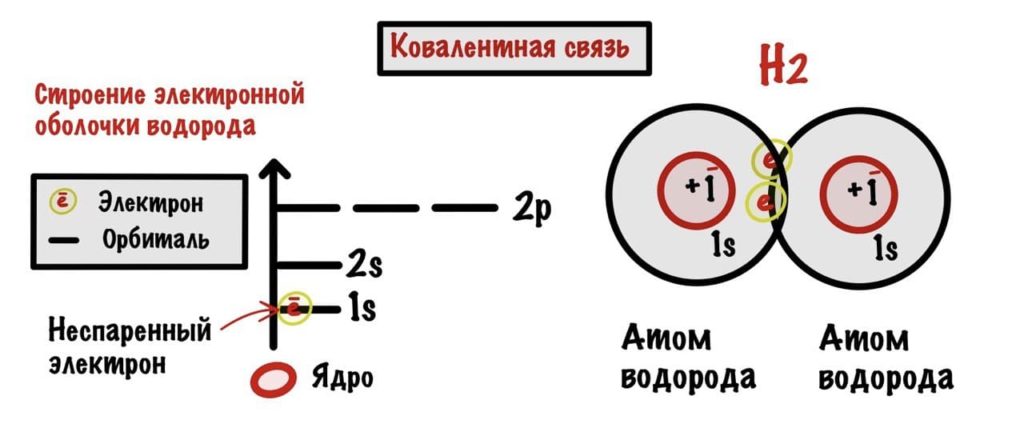
У атомов на внешнем слое есть неспаренные электроны. Они решают поделиться ими с другими атомами и образовать связь.
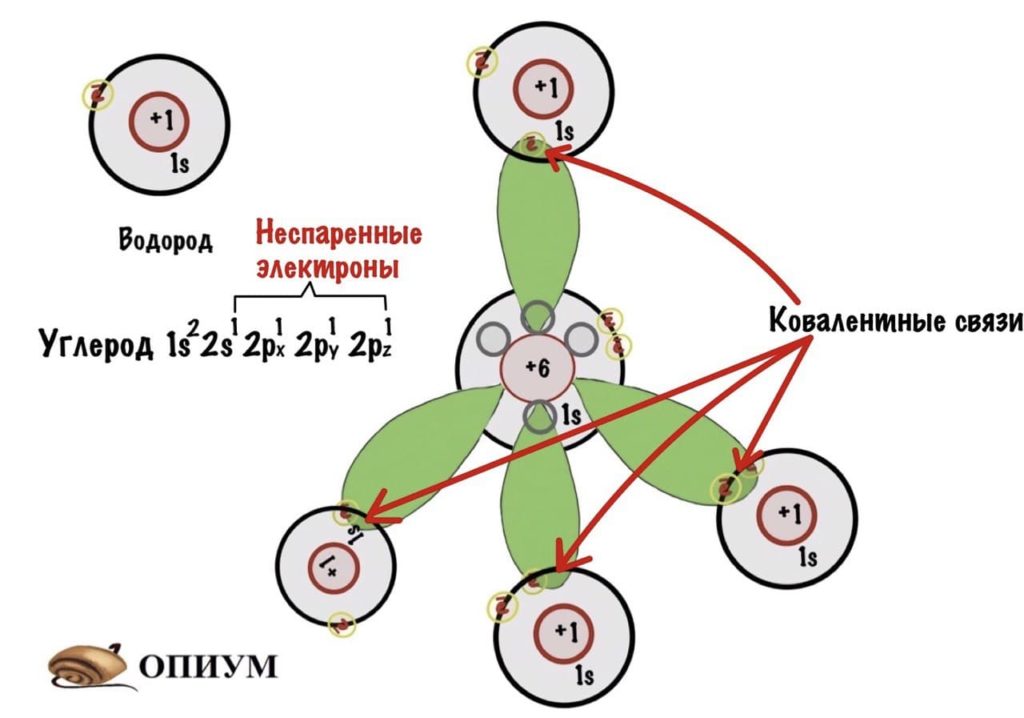
Или вот ковалентная связь между атомом углерода и четырьмя атомами водорода в молекуле метана. Здесь перекрываются s-орбитали водорода и sp3-орбитали углерода.
Донорно-акцепторный механизм
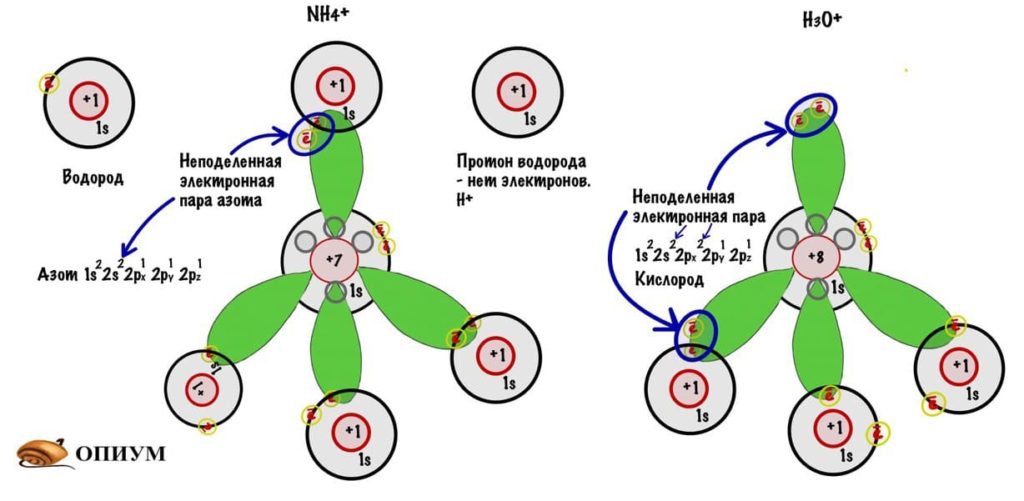
У одного атома есть неподеленная электронная пара — два электрона на одной орбитали, а у другого есть пустая орбиталь. Если первый атом очень щедрый, то он может отдать свой электрон другому атому и образовать связь. Так образуются ионы аммония и гидроксония — аммиак и вода присоединяют протон водорода (у него нет электрона).
Ну это все понятно, но для чего нужна была электроотрицательность? А вот для чего — ковалентная связь бывает неполярной и полярной.
Ковалентная неполярная химическая связь
Здесь в образовании связи участвуют два атома с одинаковой электроотрицательностью, например — два водорода, два кислорода и так далее.
Нам подойдет один из прошлых рисунков с образованием водорода. Так как электроотрицательность у атомов одинаковая, то общая электронная пара не смещается к какому-либо атому, а лежит посерединке.
Ковалентная полярная химическая связь
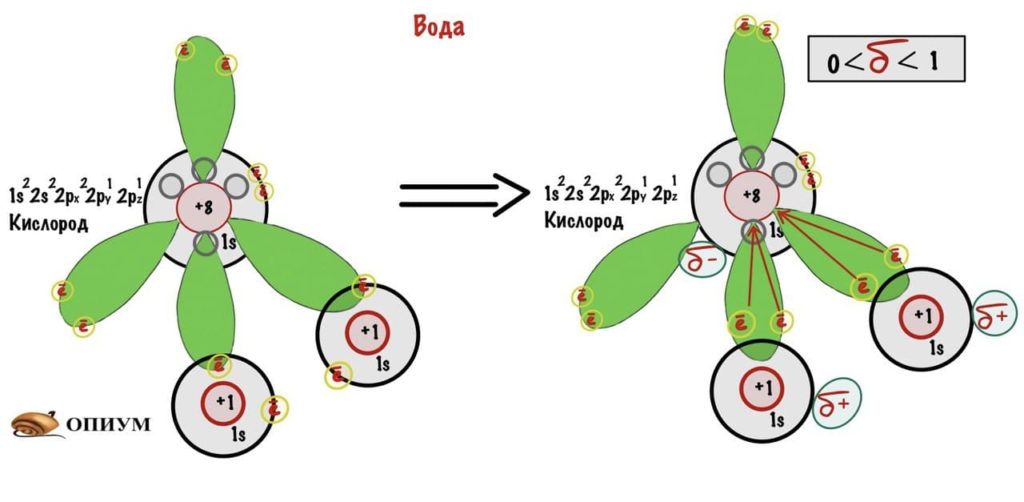
Здесь все интереснее. Атомы играют в перетягивание канатов — только тянут они не канаты, а общую электронную пару. У кого больше электроотрицательность, тот и пан. При этом на атоме, который оттягивает электроны, создается частичный отрицательный заряд. А на другом атоме создается частичный положительный заряд. Такие заряды называются — дельта-заряды. Смотрите, если атом утянет электроны с концами, то на нем будет заряд -1. Тут же ситуация иная, электроны просто проводят больше времени со стороны одного атома, но он их полностью не утягивает. Поэтому заряд на нем не -1, а от 0 до 1.
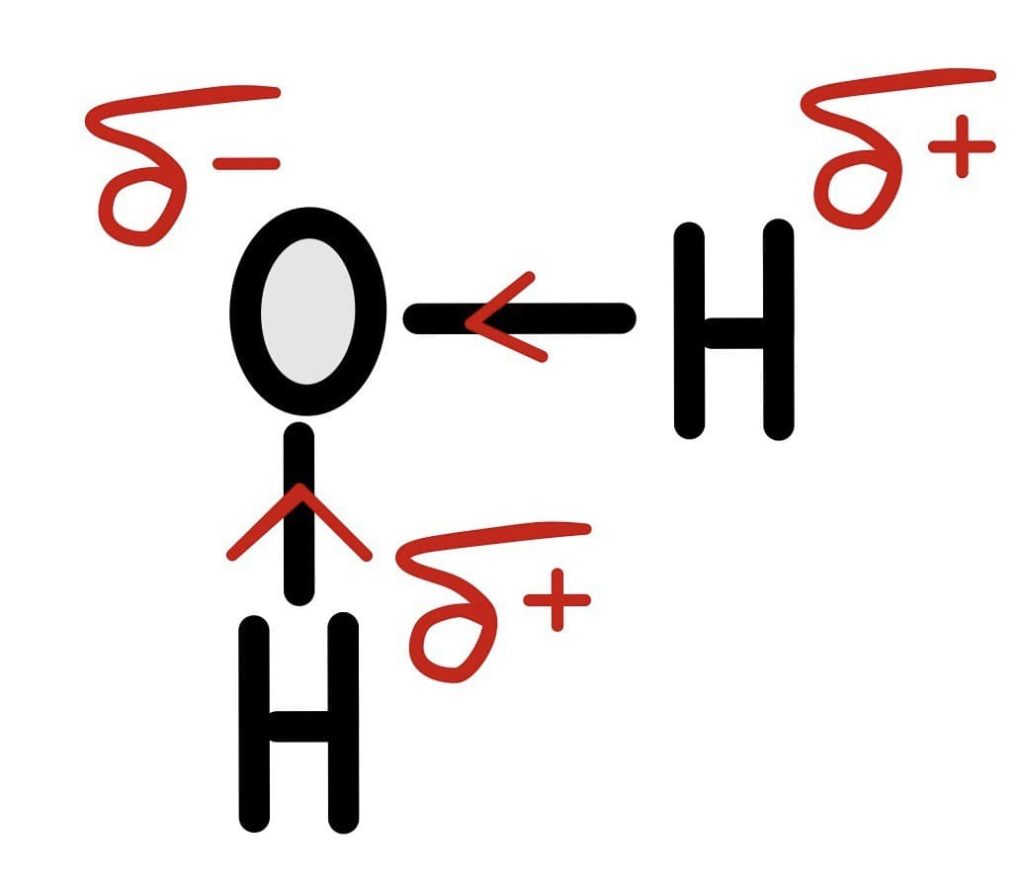
После образования связи атом кислорода начинает тянуть электронную пару на себя. Она проводит больше времени с его стороны, так как у электронов отрицательный заряд, то и заряд на кислороде становится частично отрицательным — δ-заряд. Можно нарисовать это попроще.
Мы можем сделать вывод, что чем больше разность электроотрицательности у атомов, тем больше полярность связи. Если возьмем какой-нибудь оксид азота, то кислород будет меньше оттягивать на себя электроны, так как электроотрицательность у них не слишком различается. А это значит, что и дельта заряд на кислороде и азоте будет меньше.
Но если мы возьмем молекулу воды, то разница в электроотрицательности кислорода и водорода большая. Значит дельта заряды и полярность связи будут побольше
Полярность молекулы
Раз уж мы здесь, то давайте сразу определимся от чего зависит полярность молекулы. Это важно для понимания того, какие молекулы свободно пройдут через биологическую мембрану, а какие нет. Полярность молекулы зависит от полярности связей между атомами и геометрии молекулы. Если все связи в молекуле неполярные, то и молекула неполярная, например O2. Такие молекулы легко проходят через мембрану.
Посложнее с полярными связями. Здесь все зависит от геометрии молекулы. Геометрия молекулы может быть симметричной — у нее нет неподеленных электронных пар и неспаренных электронов, например CO2. Значит CO2 тоже легко пройдет через мембрану.
Но если у молекулы есть неподеленные электронные пары или неспаренные электроны, то она асимметрична. Значит она полярна, например H2O и NH3.


Такие молекулы будут хуже проходить через мембрану. Вода транспортируется через специальные белки — поры (аквапорины). Кстати, возможно аквапорины еще нужны потому, что вода в растворе переходит в ион гидроксония. Ион гидроксония — это полярная и заряженная молекула, которая практически не будет проходить через мембрану.
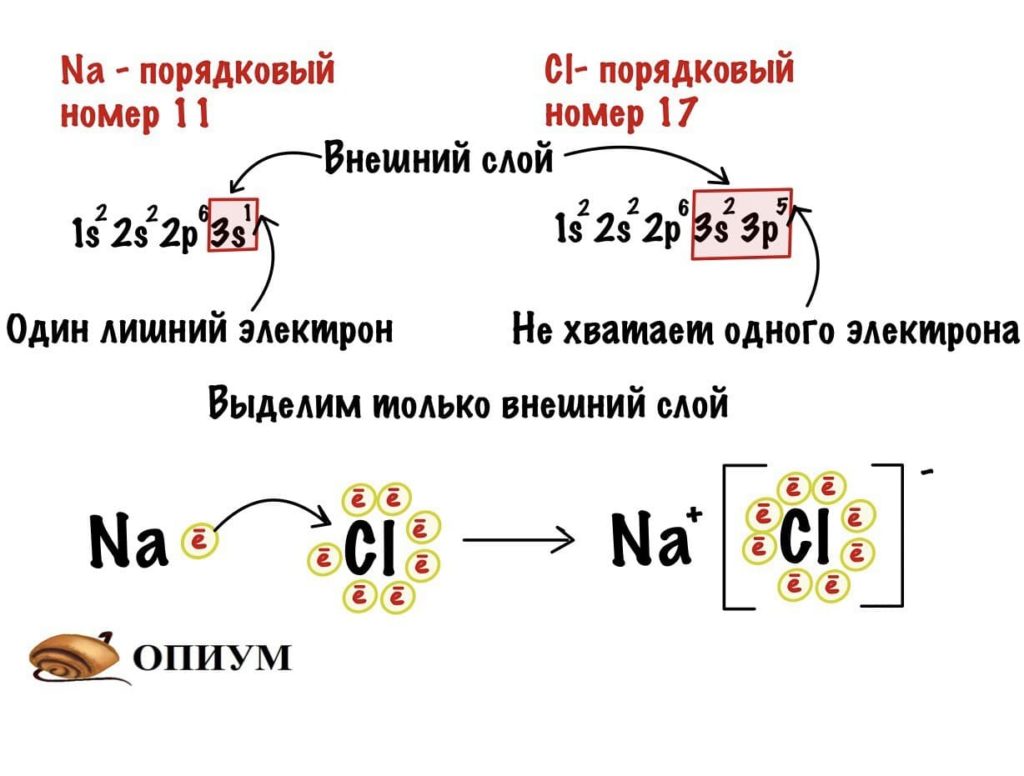
Ионная связь
Она образуется в случае, когда разница в электроотрицательности между двумя атомами просто огромная! Мы знаем, что атомы стараются полностью заполнить свои энергетические слои. Как это можно сделать? Можно отдать лишний электрон или присоединить электрон к себе. Когда два таких атома встречаются, то один из них отдает электроны, а другой принимает — отдает обычно щелочной/щелочно-земельный металл или водород. В итоге один атом становится заряжен отрицательно — анион, а другой положительно — катион. Они удерживаются друг с другом благодаря силам электростатического взаимодействия — разноименные заряды притягиваются. Да, да, я опять пишу эту банальщину.
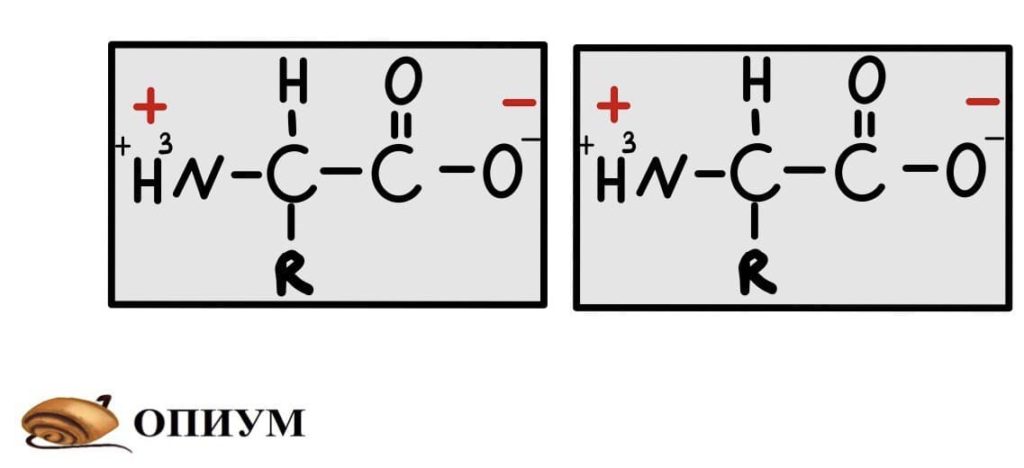
Или вот ионная связь между молекулами аминокислот.
Сведем все в табличку.
Межмолекулярные химические связи
Здесь взаимодействуют не атомы, а молекулы. Капитан очевидность. В таких связях очень маленькое количество энергии, но их настолько много, что они придают стабильность большим системам — белок, ДНК. Два варианта — водородные связи и и силы Ван-дер-Ваальса.
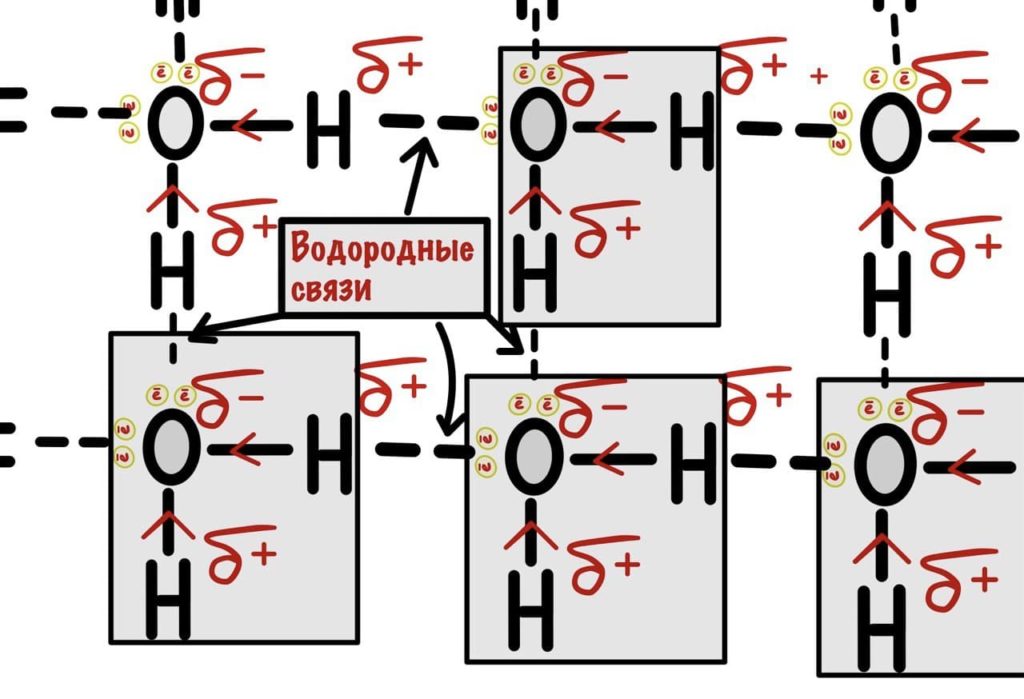
Водородная связь
Водородная связь — это связь атома водорода одной молекулы с атомом другой молекулы. Звучит просто, но она может образоваться не всегда. Есть условия, о которых мы сейчас поговорим:
- Атом водорода связан с сильно электроотрицательным элементом — N, O, F. Из-за этого на нем создается частичный положительный заряд — дельта +. Мы уже об этом говорили.
- Атом другой молекулы, с которым должен связаться кислород, имеет сильную электроотрицательность — N, O, F. Из-за этого на нем создается частичный отрицательный заряд — дельта -.
С помощью водородных связей образуются вторичная структура белка и вторичная структура ДНК.
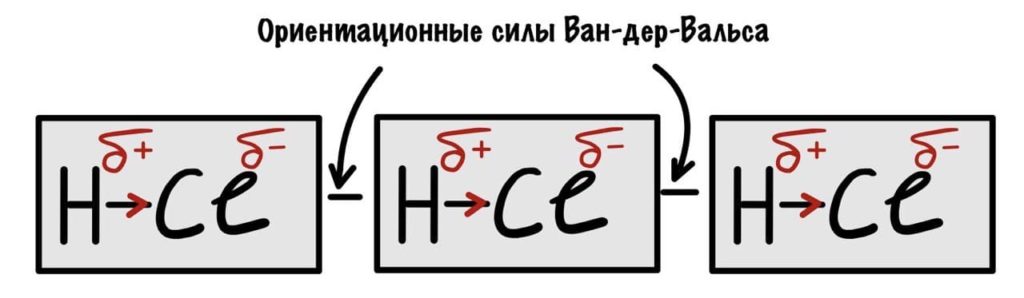
Силы Ван-дер-Ваальса
Там три варианта, но я остановлюсь только на двух — ориентационных и индукционных взаимодействиях. Сначала ориентационные, с ними полегче. Проще будет просто показать это.
Такие молекулы называют диполями — у них есть положительно и отрицательно заряженные части. Молекулы ориентируются друг на друга: положительные части располагаются рядом с отрицательными и между ними образуются слабые связи. Ну вы поняли, что такая тема может идти только в соединениях с ковалентной полярной связью.
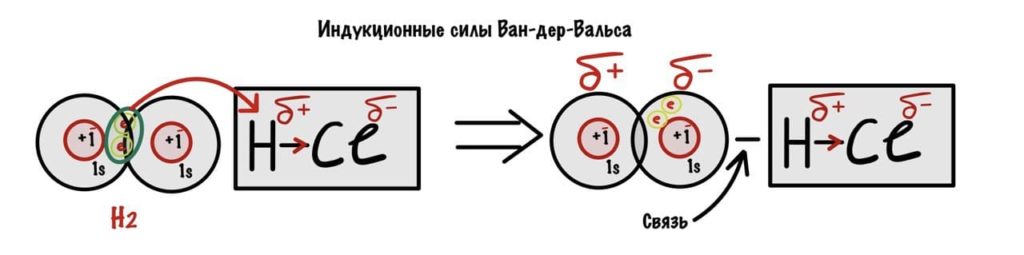
Теперь индукционные. Смотрите, есть одна молекула — HCl, у нее есть дельта-положительно заряженный водород. Вдруг такая молекула подходит к молекуле, где связь неполярная, например водороду. Что было дальше? А вот что, дельта-положительный водород начинает оттягивать на себя электронную пару из молекулы. Тут то и образуется диполь.
Табличка?