Общий путь катаболизма: окислительное фосфорилирование
Эта тема входит в мой курс по биохимии
Окислительное фосфорилирование — это заключительный этап общего катаболизма. Напомню, что он включает: окислительное декарбоксилирование пирувата, цикл Кребса и окислительное фосфорилирование. Про первые два говорили здесь.
Окислительное фосфорилирование — сложный процесс. Он включает три этапа: перенос электронов по дыхательной цепи, создание градиента концентрации протонов и синтез АТФ. Не слишком понятно, не правда ли? Ничего, сейчас разберёмся. Но сначала нужно вспомнить кое-что.
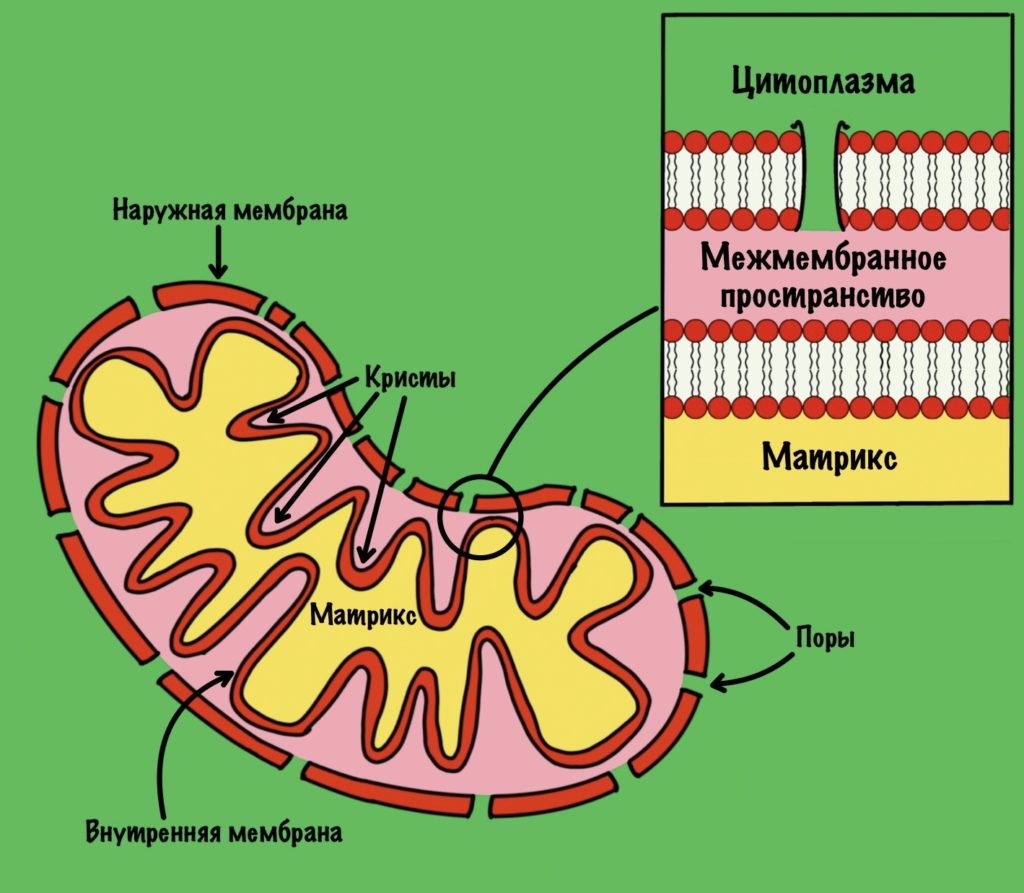
Общий путь катаболизма идёт в митохондрии. Нам нужно разобраться со строением мембран митохондрии, потому что без этого мы далеко не уедем. У митохондрии есть две мембраны: наружная и внутренняя. В наружной мембране есть поры, поэтому она проницаема для небольших молекул, в том числе ионов. Внутренняя мембрана непроницаема для любых молекул — там нет пор. Тут я загнул, всё-таки есть жирорастворимые молекулы, которым на мембрану плевать.
Внутренняя мембрана увеличивает свою площадь за счет формирования крист. Видите, какая она неровная? Матрикс — это пространство между внутренней мембраной. А между внутренней и наружной мембранами находится мемжмембранное пространство.
Зачем нужно было это вспомнить? Потому что во внутренней мембране находится дыхательная цепь (или цепь переноса электронов). Чем больше площадь этой мембраны, тем больше в ней комплексов дыхательной цепи. Да-да, она состоит из нескольких комплексов, но пока что нужно запомнить вот это:
Внутренняя мембрана непроницаема для молекул
Можно обойти этот запрет. Для этого нужны белки переносчики, которые перекинут молекулу на другую сторону.
Окислительное фосфорилирование
Теперь займёмся окислительным фосфорилированием. Какая была основная суть у катаболизма? Вытащить максимальное количество электронов из молекулы — с этим он отлично справился, если вспомнить катаболизм одной молекулы глюкозы, то в ходе неё были получены 24 электрона — в виде НАДH и ФАДH2. Из них: четыре в гликолизе, четыре в окислительном декарбоксилировании пирувата и шестнадцать в цикле трикарбоновых кислот.
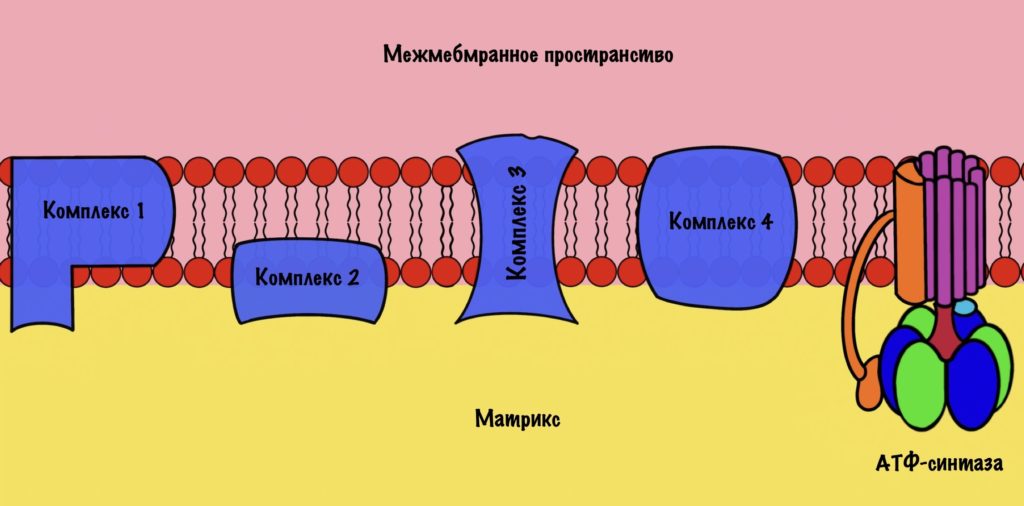
Зачем это было нужно? Для окислительного фосфорилирования, а если точнее, то одной из его частей — цепи переноса электронов. Мы договорились, что она находится во внутренней мембране митохондрий. Дыхательная цепь состоит из четырёх комплексов, но пока не будем лезть в дебри. Сейчас просто разберёмся с механизмом окислительного фофорилирования.
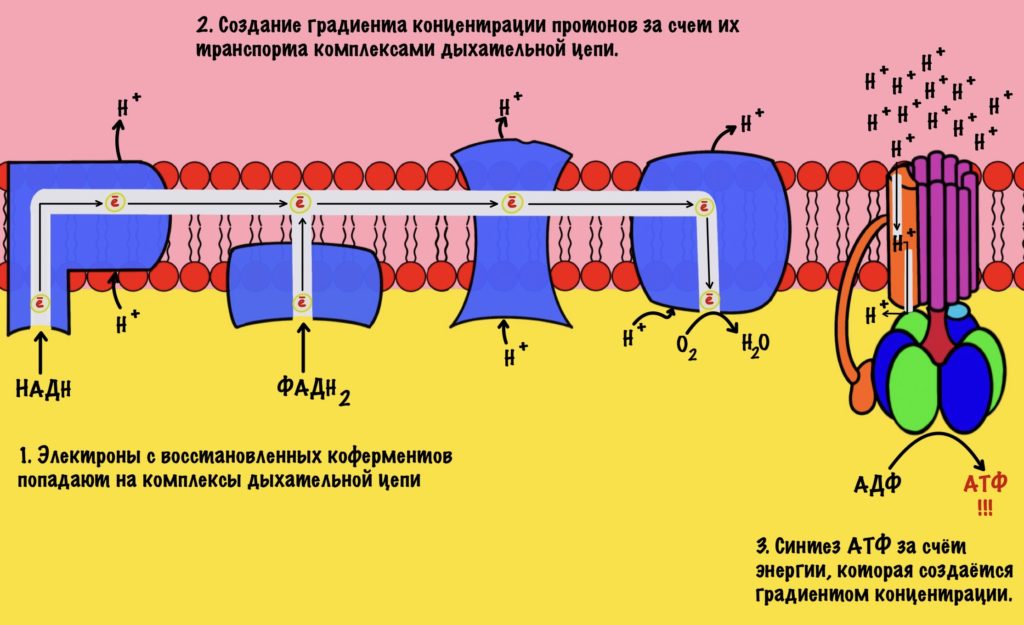
Электроны, которые были получены в ходе катаболизма, попадают на комплексы дыхательной цепи. Там они перескакивают с одного комплекса на другой, пока не попадут на кислород. В ходе таких перескоков создаётся энергия. Сразу скажу, что её не слишком много. Но достаточно для того, чтобы транспортировать протоны из матрикса в межмембранное пространство. За счёт этого создаётся градиент концентрации протонов. Протоны стараются попасть обратно в матрикс митохондрий, но мембрана для них непроницаема. Так они и бьются в мембрану, пока не попадают на АТФ-синтазу. Можно подумать, что АТФ-синтаза это канал для протонов, но это не совсем так. Транспорт протонов из межмембранного пространства в матрикс создаёт большое количество энергии. Эта энергия используется АТФ-синтазой для синтеза АТФ. Чем-то напоминает вторично-активный транспорт.
Представьте себе шланг. Вода под большим давлением идёт по шлангу, пока не дойдёт до его конца. Чем больше давление в шланге, тем сильнее из него вырывается вода. Примерно такой же принцип в работе окислительного фосфорилирования. Только напор воды создаёт дыхательная цепь, а единственное место выхода для неё — это АТФ-синтаза. Вода — это протоны водорода.
Из этого можно сделать вывод. Если мы не создадим градиент концентрации, то синтеза АТФ не будет. Получается, что работа цепи переноса электронов сопряжена с работой АТФ-синтазы. Это и есть окислительное фосфорилирование. В нём сопряжены три процесса: транспорт электронов по дыхательной цепи, транспорт протонов в межмембранное пространство и синтез АТФ. За первые два процесса отвечает дыхательная цепь, а за последний — АТФ-синтаза. Теперь, когда мы уяснили себе этот принцип, можно лезть в дебри!
Синтез АТФ сопряжён с работой дыхательной цепи
Дыхательная цепь состоит из четырёх комплексов
Комплексы — это гигантские белки. Они пронизывают внутреннюю мембрану митохондрий. Первый и второй комплекс принимают на себя электроны от восстановленных коферментов: НАДH и ФАДH2. При этом на первый комплекс попадают электроны с НАДH, а на второй комплекс с ФАДH2. Дальше мы поговорим об этом подробнее. Пока давайте ответим на простой вопрос: «Как заставить электроны перемещаться по дыхательной цепи?».
Электронам не выгодно прыгать с одного комплекса на другой. Им нет дела до создания градиента концентрации протонов. Митохондрии нужно заставить их перемещаться вдоль этой цепи. Для этого в комплексах дыхательной цепи находятся: коферменты, железо-серные белки, цитохромы и медь. Их строение будет разобрано далее. Но как они заставляют электроны передвигаться? С помощью редокс потенциалов. У них есть и другое название — окислительно-восстановительные потенциалы.
Дело тут такое, у молекул различное сродство к электронам. Чем больше окислительно-восстановительный потенциал молекулы, тем больше у неё сродство к электронам. Если расположить молекулы в порядке возрастания их потенциалов, то мы заставим двигаться электроны вдоль дыхательной цепи. На каждом комплексе у нас будет молекула, которая любит электроны больше, чем на предыдущем. Это заставит их работать! Вот редокс потенциалы для разных молекул.


Мы видим, что максимальный редокс потенциал у кислорода. У остальных молекул поменьше. Они будут располагаться в дыхательной цепи именно в такой последовательности — возрастания окислительно-восстановительных потенциалов.
У разных молекул — разные редокс потенциалы.
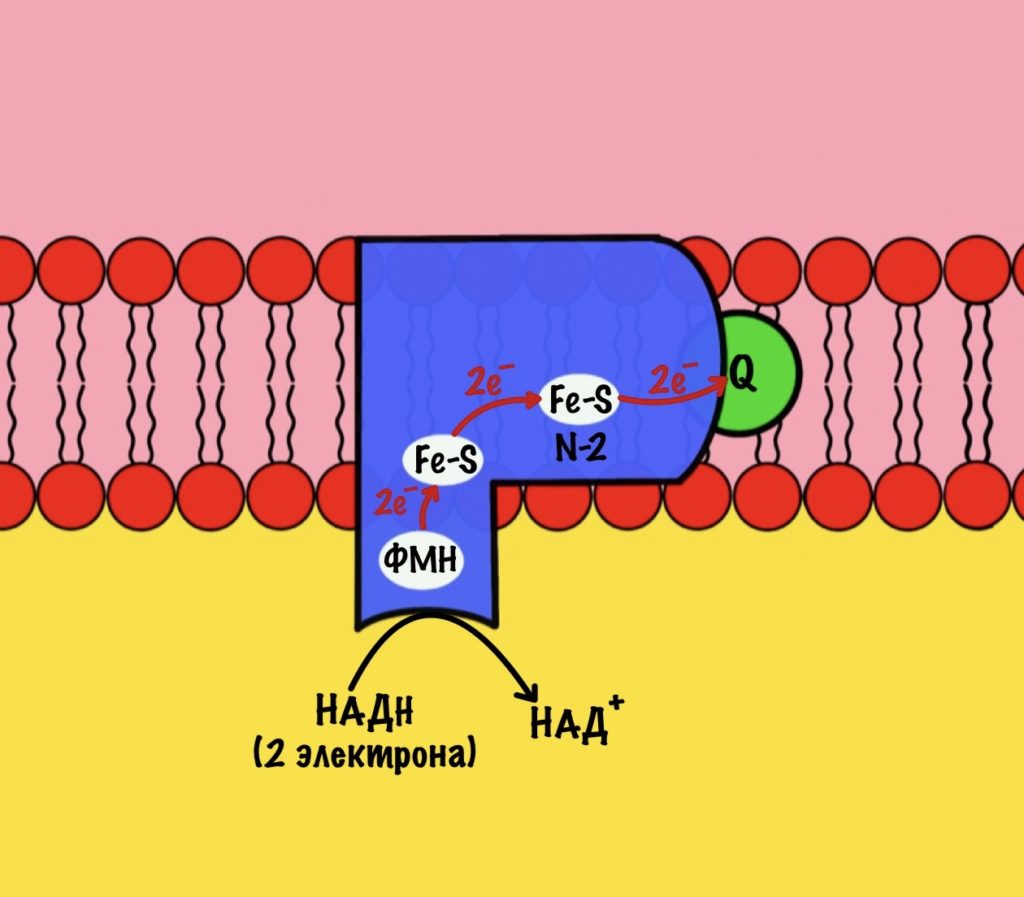
Комплекс 1 — НАДH-дегидрогеназа
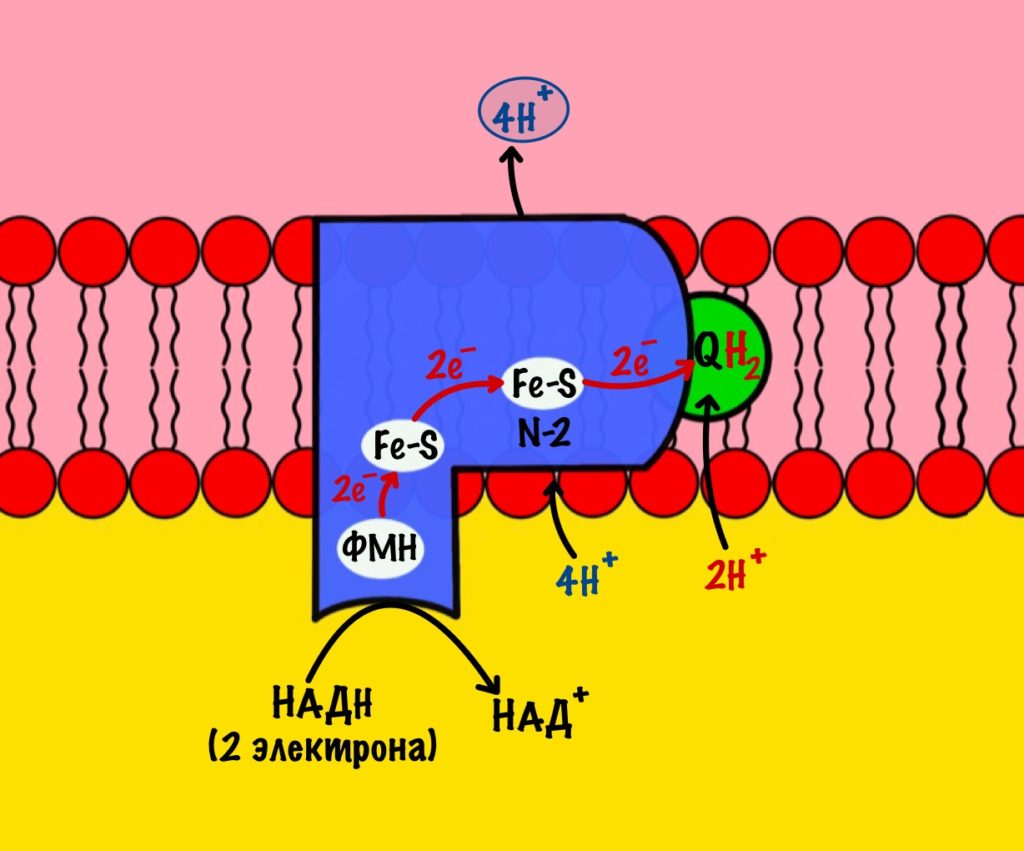
Этот комплекс состоит из 45 полипептидных цепей! В его состав входит ФМН и железо-серные белки. Его основная задача — принять электроны от НАДH и переместить на убихинон (коэнзим Q10). Комплекс похож на перевёрнутую букву L: часть выходит в матрикс, а другая находится в мембране.
Восстановленный НАДH — из общего катаболизма — отдаёт гидрид ион (два электрона и протон) этому комплексу. Электроны сначала попадают на ФМН, а потом на железо-серные белки — всего их восемь. Я не буду рисовать их все, а нарисую только пару, последний — N-2.
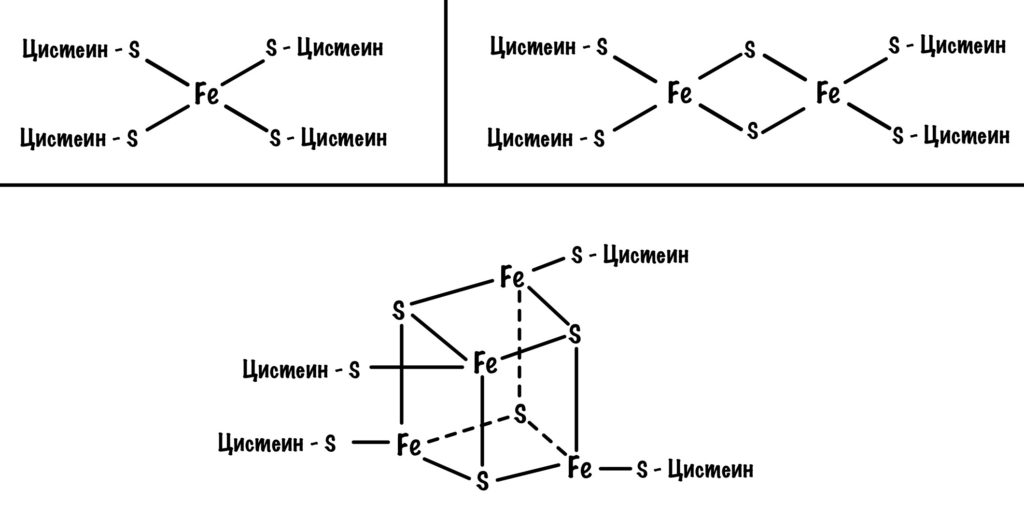
Давайте посмотрим на строение железо-серных белков. Они могут включать один атом железа, два или четыре. Самые простые включают один атом железа — оно связано с четырьмя -SH группами. Железо-серные белки c двумя и четырьмя атомами железа связаны не только с остатками цистеина, но и неорганической серой.
Железо в этих белках имеет заряд +3, но оно может присоединить электрон и перейти в +2. Это и происходит, когда электроны передвигаются от одного железно-серного белка к другому. Чем больше атомов железа в таких белках, тем больше электронов они могут присоединить к себе. Они что-то вроде склада электронов.
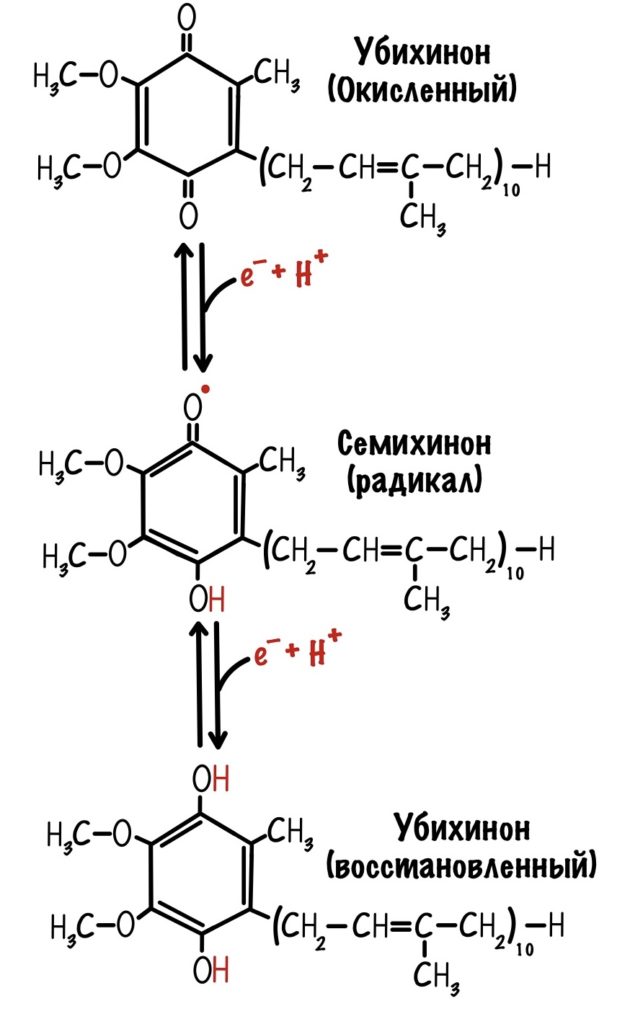
Последний железо-серный белок — N-2. Этот белок отдаёт электроны на убихинон. Убихинон — это жирорастворимая молекула, которая находится во внутренней мембране. Она присоединяется к первому комплексу и ждёт, пока комплекс отдаст ей электроны. Также он присоединяет два протона — один от НАДH, а другой из матрикса митохондрий. Вот как выглядит эта молекула. Убихинон переходит в восстановленную форму.
Мы видим то, о чём говорили в начале — серию окислительно-восстановительных реакций. Электроны из НАДH, через серию переносчиков первого комплекса, попадают на коэнзим Q10. В ходе этой серии реакций выделяется энергия. Энергия идёт на транспорт четырёх протонов из матрикса в межмембранное пространство. Точный механизм транспорта неизвестен, но он подтверждён практически. Так что первый комплекс — протонная помпа.
Первый комплекс переносит два электрона с НАДH на коэнзим Q10. Энергия окислительно-восстановительных реакций используется на транспорт четырёх протонов из матрикса в межмембранное пространство.
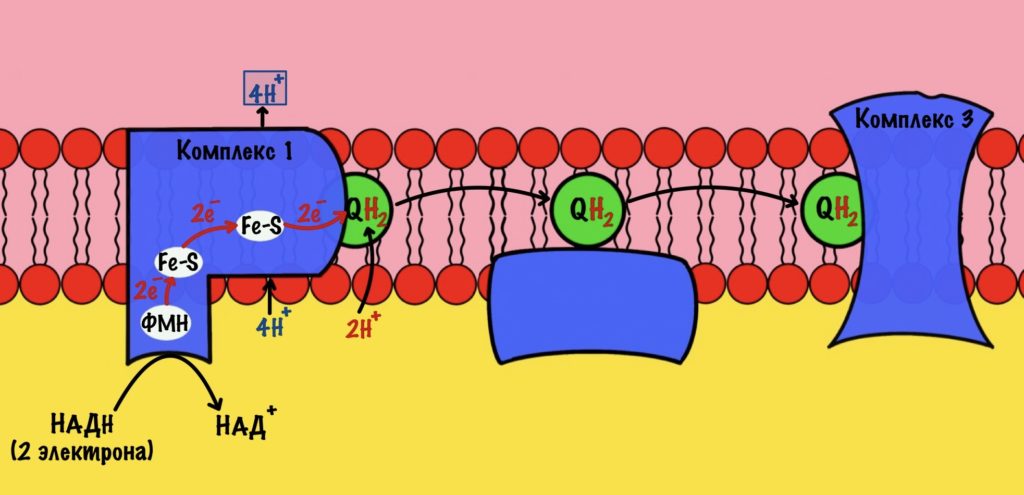
Далее убихинон отсоединяется от первого комплекса и путешествует по внутренней мембране. Он жирорастворимый, поэтому это не составляет ему труда. Восстановленный убихинон присоединится к третьему комплексу, которому и отдаст свои электроны и протоны.
Стоп, а где второй комплекс? Их же всего четыре, почему убихинон переносит электроны сразу на третий? А сейчас разберёмся.
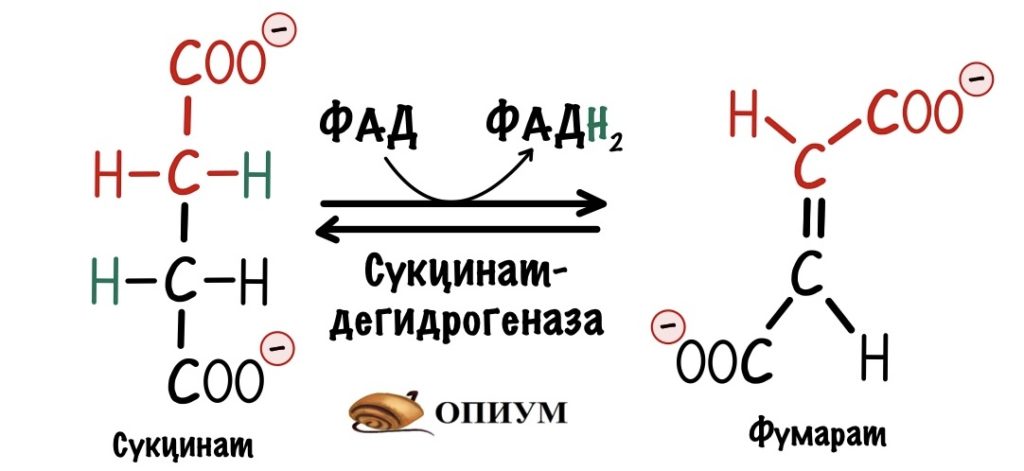
Второй комплекс — сукцинатдегидрогеназа
Мы уже встречались с ним — в реакциях цикла Кребса! Сукцинатдегидрогеназа катализировала превращение сукцината в фумарат. Кофермент этой реакции — ФАД. Это единственный фермент из цикла трикарбоновых кислот, который крепится к внутренней мембране митохондрий.
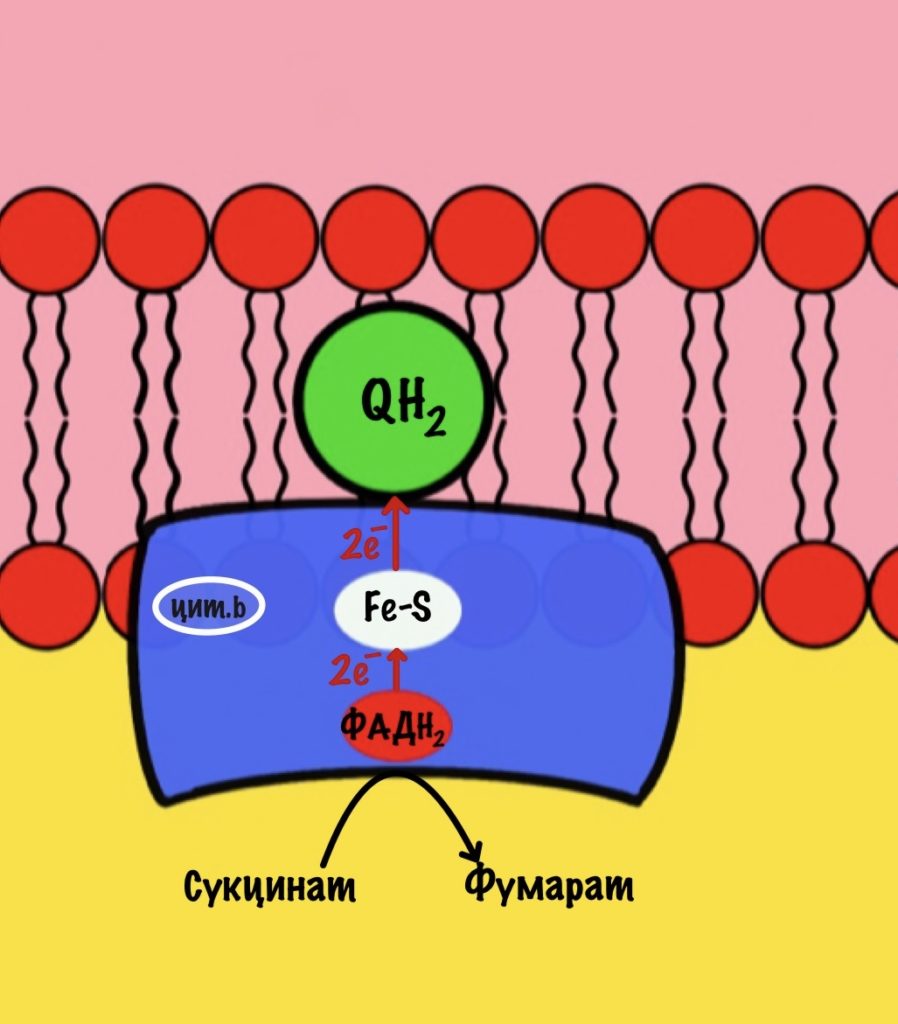
Задача второго комплекса — транспорт электронов с ФАДH2 их на убихинон. Второй комплекс намного меньше первого, он включает четыре субъединицы. Только одна ответственна за реакцию сукцинатдегидрогеназы — субъединица А. Кофермент ФАД тесно связан с этим комплексом. Остальные субъединицы транспортируют электроны. В комплексе есть три железо-серных белка и цитохром b. Железо-серные белки переносят электроны на убихинон. Цитохром b не участвует в транспорте электронов, он нужен для избежания утечек электронов. Иногда электроны сбиваются со своего пути, а это может привести к образованию токсичных форм кислорода. Это радикалы, которые могут натворить много неприятных дел внутри клетки. Так что цитохром b на подсейве.
Убихинон принимает электроны с ФАДH2 не только от сукцинатдегидрогеназной реакции. Например, он может присоединять электроны, которые образовались в глицеролфосфатном челноке.
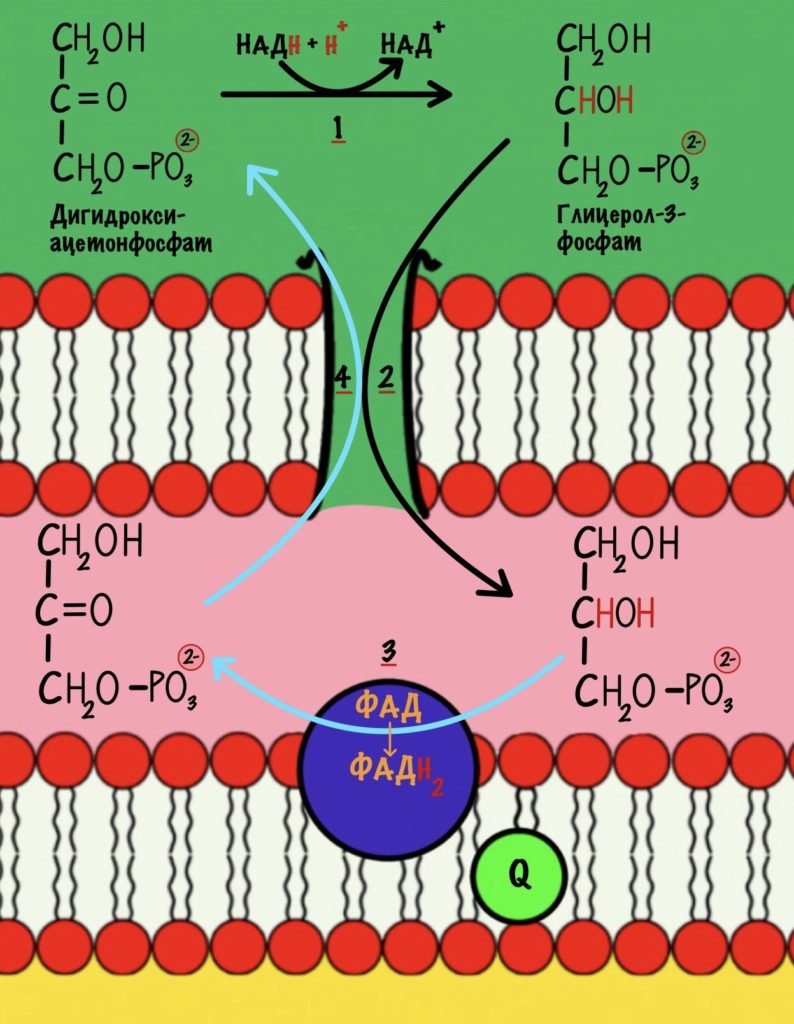

Второй комплекс не работает, как протонная помпа. Он не транспортирует протоны из матрикса в межмемрбанное пространство.
Второй комплекс переносит два электрона от ФАДH2 на убихинон. Энергия окислительно-восстановительных реакций не используется на транспорт протонов.
Дальше убихинон будет путешествовать по мембране, пока не присоединится к третьему комплексу. Там он отдаст электроны и протоны.
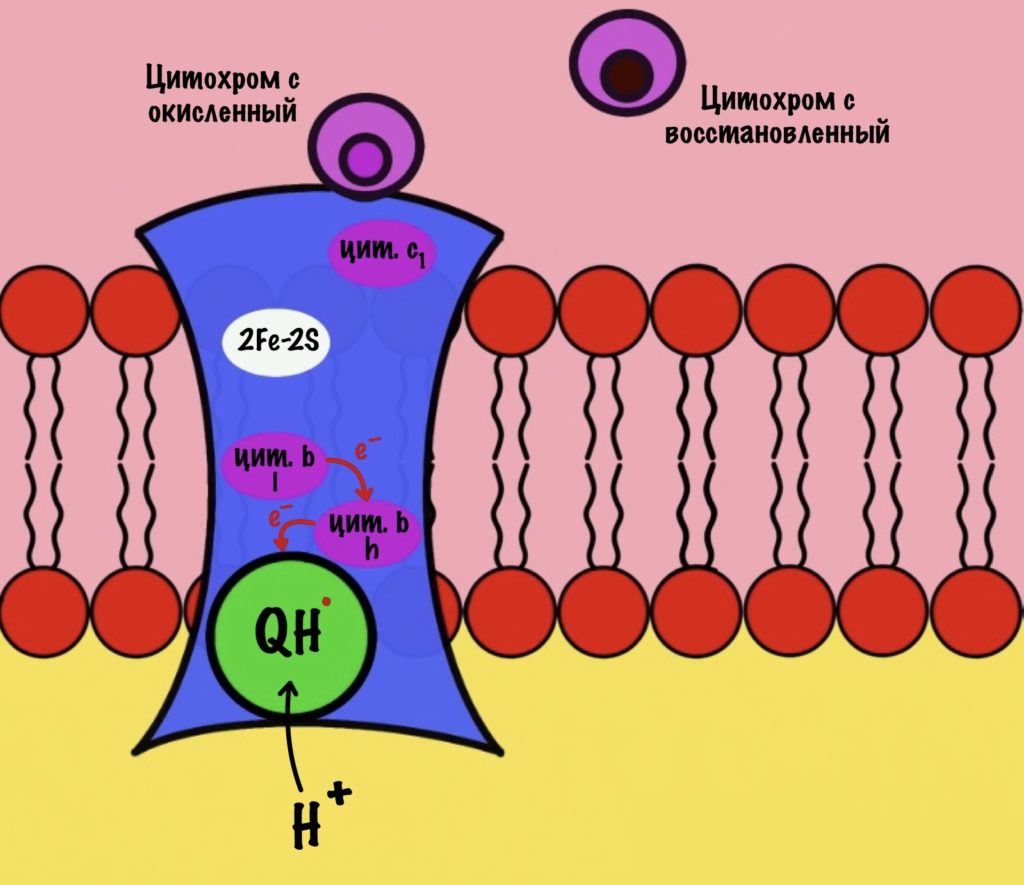
Третий комплекс — цитохром bc1 комплекс
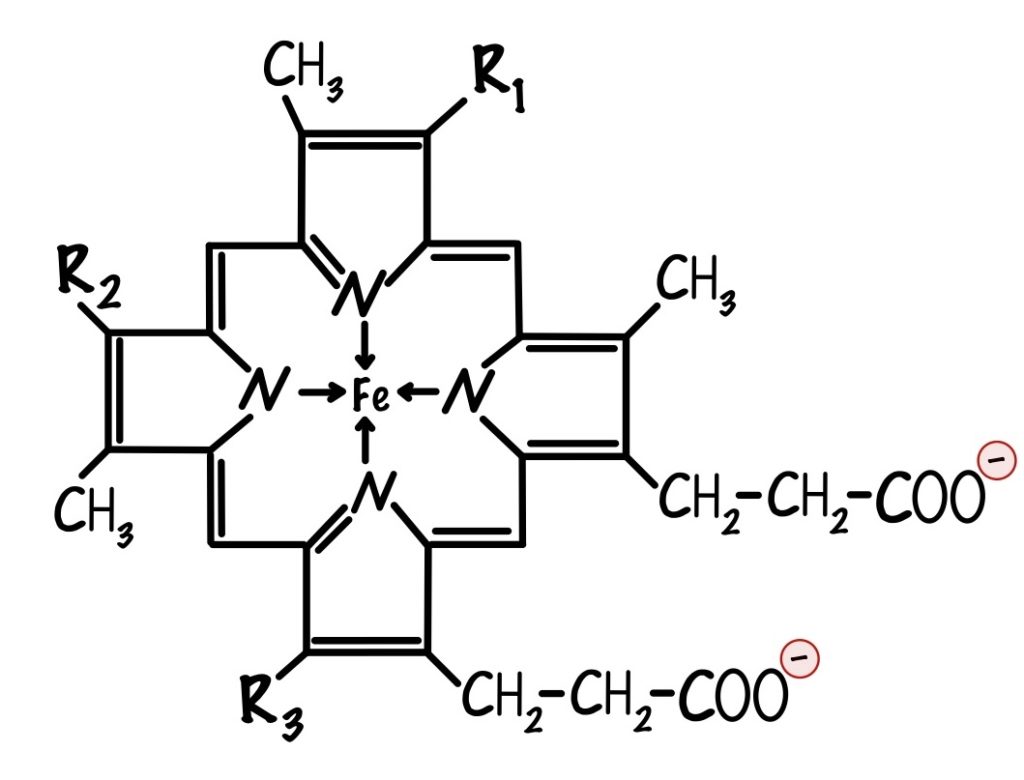
Мы ещё не встречались с цитохромами, что это такое? Цитохромы — это белки, которые содержат в себе гем. Гем состоит из порфирина, который соединен с железом. Порфирин состоит из четырёх пятичленных колец. В каждом кольце есть атом азота, с помощью которого кольца соединяются с атомом железа. У порфирина могут быть разные радикалы, по ним цитохромы делятся на разные типы.
Важно понять, что в цитохромах есть один атом железа. Он может принимать электрон и менять степень окисления: из +3 в +2. Цитохромы могут принимать только один электрон, потому что в них один атом железа.
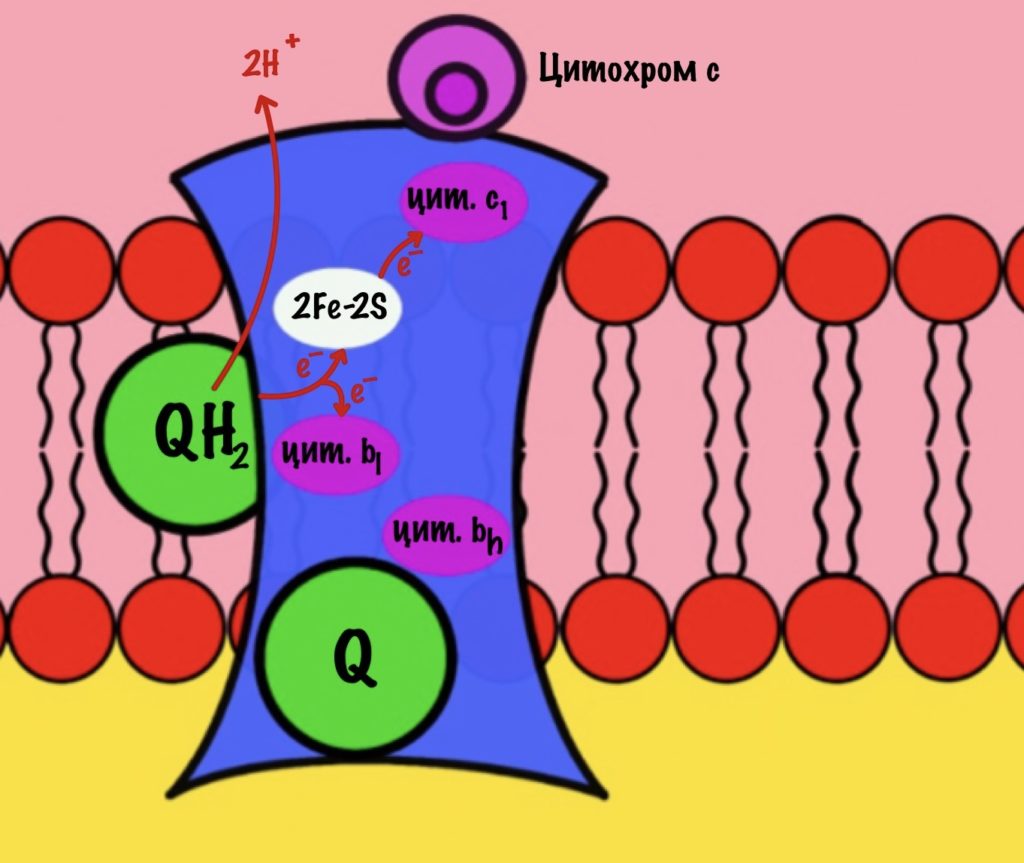
Третий комплекс состоит из двух субъединиц. В каждой субъединице есть: 2Fe-2S железо-серный белок, цитохром b, цитохром c1. В цитохроме b есть два порфириновых кольца, поэтому его делят на l и h. К субъединицам крепится цитохром c — он находится в межмембранном пространстве митохондрии. Цитохром c растворим в воде, в отличие от остальных цитохромов.
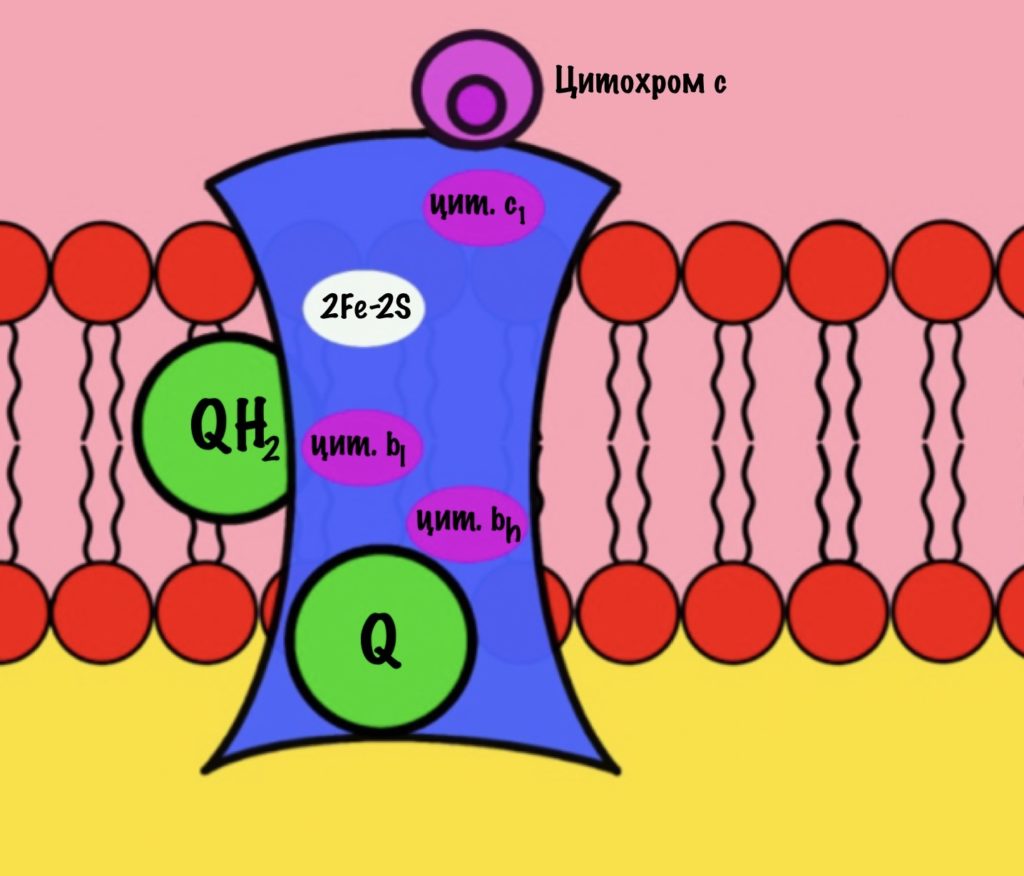

Задача этого комплекса — транспорт электронов с восстановленного убихинона на цитохром c. Разберём на примере одной субъединицы.
К комплексу присоединяется восстановленный убихинон. Он отдаёт один электрон на цитохром b, а другой на железо-серный белок. Дальше железо-серный белок отдаст электрон цитохрому c1. Почему только один? Вспоминаем, что железо может присоединить только один электрон — перейти в +2. Поэтому нужна такая развилка для электронов. В это же время от убихинона отщепляются два водорода, которые транспортируются в межмембранное пространство третьим комплексом. Убихинон становится окисленным и отсоединяется от третьего комплекса.
Цитохром c1 передаёт электрон цитохрому c. Тот говорит: «до связи». И отчаливает от третьего комплекса. Дальше восстановленный цитохром c попадёт на четвёртый комплекс, но об этом пока рано. К третьему комплексу присоединится следующий окисленный цитохром c.
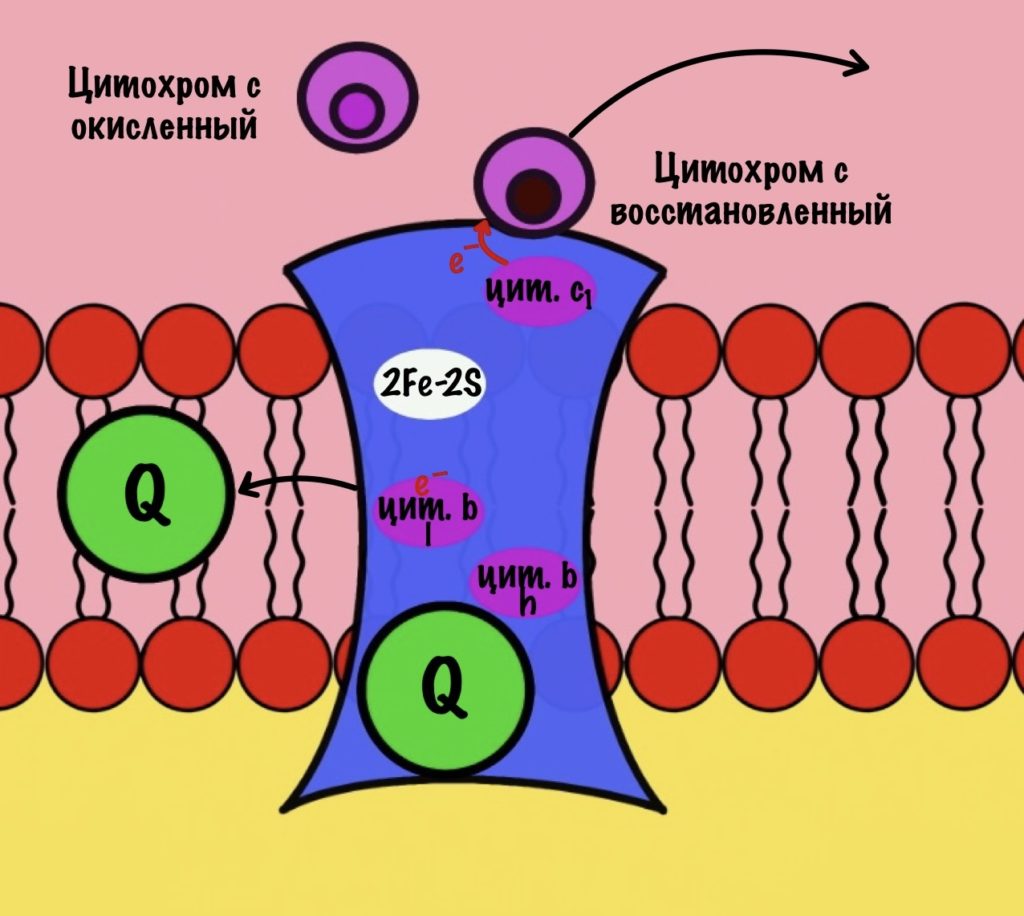

Что будет со вторым электроном? У цитохрома b есть два порфирина с железом: l и h. Электрон переходит с порфирина l на h, а дальше падает на убихинон. Но не тот же самый, а другой — окисленный. Он сидел в третьем комплексе и ждал своего часа. Также убихинон присоединяет протон водорода из матрикса — образуется полувосстановленный убихинон (семихинон). С этой молекулой пока ничего не сделаешь.
К третьему комплексу присоединяется ещё один восстановленный убихинон. Он снова отдаёт один электрон железо-серному белку, а другой цитохрому b. Два протона от убихинона вылетают в межмембранное пространство. От железо-серного белка электрон попадает на цитохром c1, а потом и на цитохром c. Ещё один электрон отправился на четвёртый комплекс.
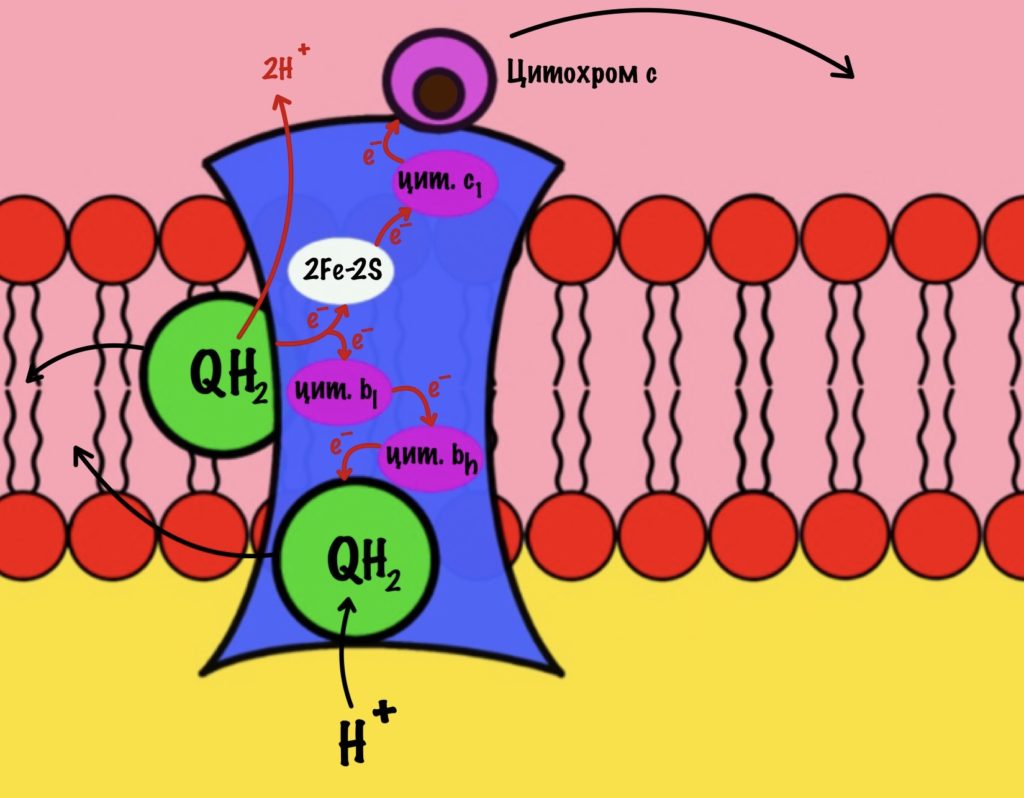

Второй электрон и протон из матрикса присоединяются к полувосстановленному убихинону, который ждёт своего часа. Он переходит в восстановленный убихинон. Восстановленный убихинон отсоединяется от третьего комплекса, чтобы присоединиться в другом месте к третьему комплексу))) Цикл завершён, у него даже есть своё название — цикл Q или убихиноновый цикл.
Третий комплекс переносит два электрона от убихинона на два цитохрома c. Энергия окислительно-восстановительных реакций используется на транспорт четырёх протонов в межмембранное пространство.
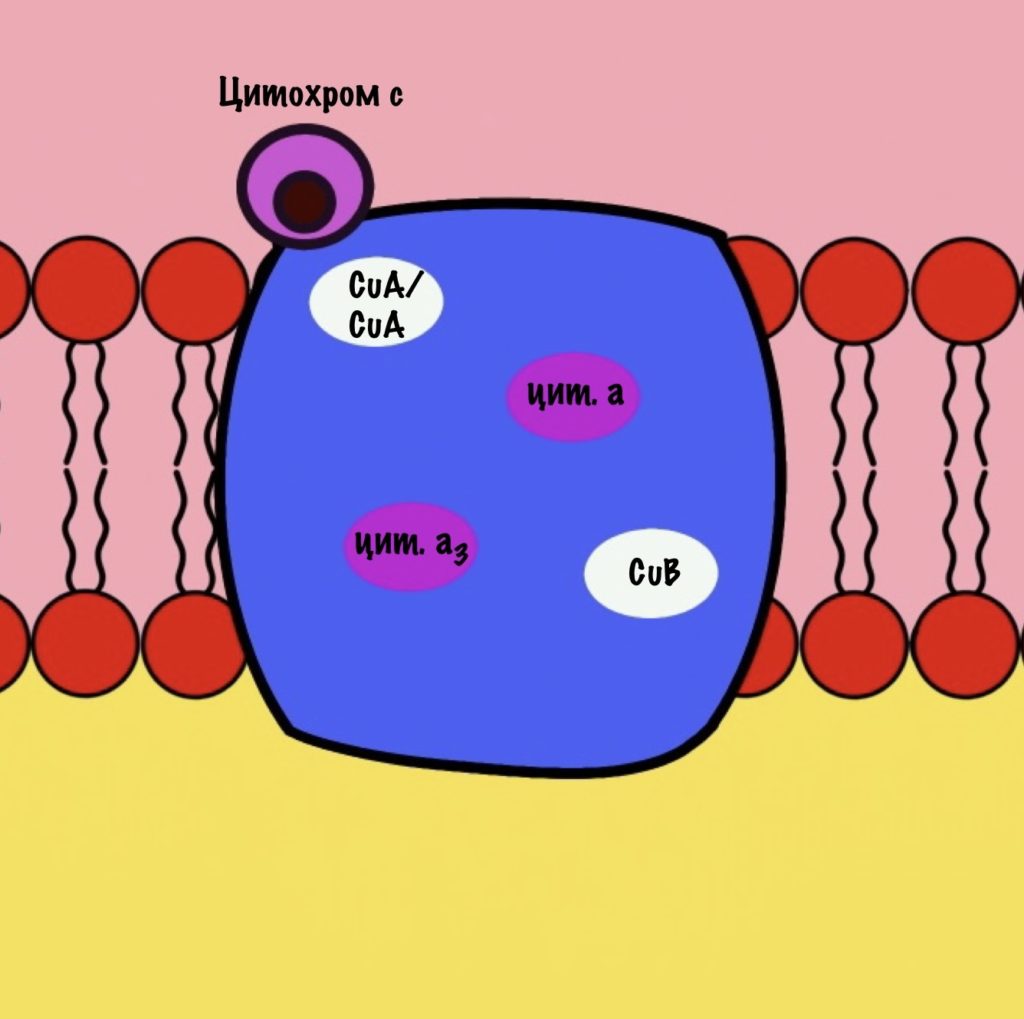
Четвёртый комплекс — цитохром c оксидаза
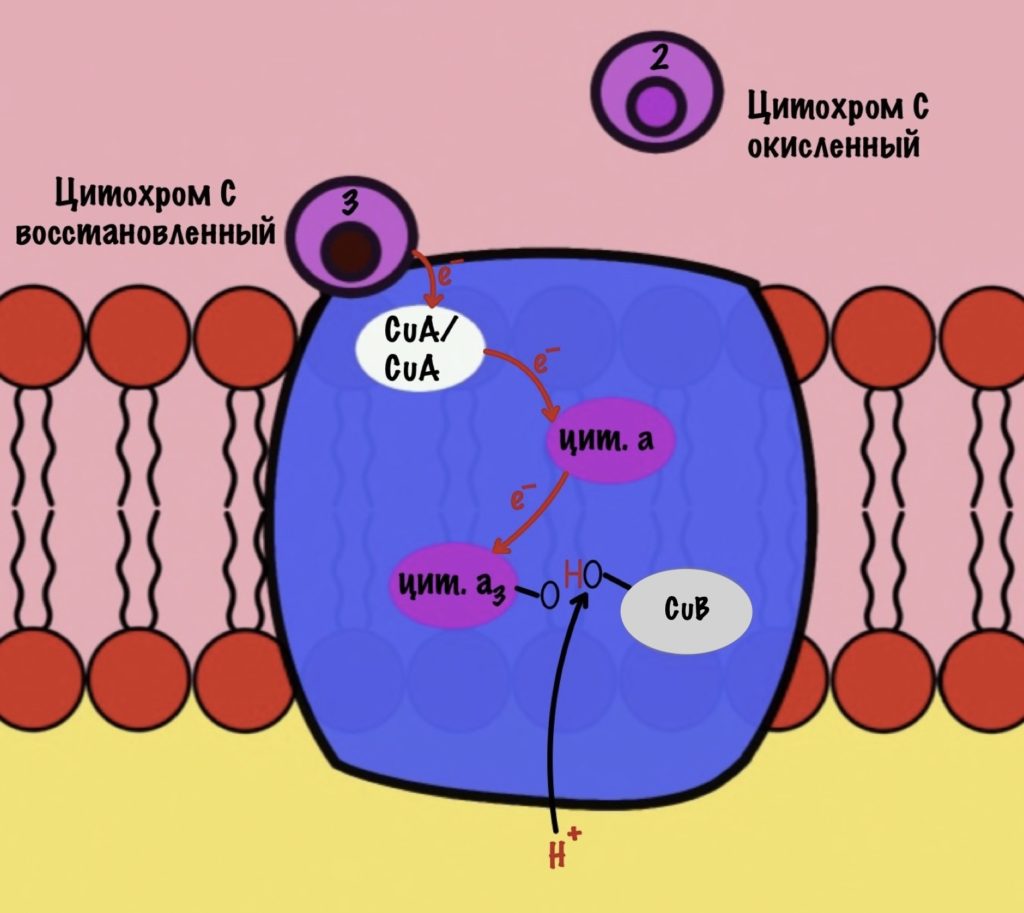
Цитохром с оксидаза имеет димерную структуру. Каждый мономер состоит из 13 субъединиц. Его задача — перенос электронов от цитохрома c на кислород. Кислород — это финальный акцептор электронов в дыхательной цепи.
Второй мономер отвечает за связывание цитохрома c и присоединение его электрона. Электрон принимают на себя два атома меди, которые связаны ковалентной связью друг с другом. К четвёртому комплексу атомы меди присоединяются с помощью цистеина, гистидина и метионина — это напоминает железо-серные белки. За счёт такого строения эти два атома могут принять только один электрон. Я запишу эти ионы вот так — CuA/CuA.
Первый мономер отвечает за передачу электронов на кислород. Он состоит из двух цитохромов: a и a3. Ещё в нём есть один ион меди +2 — CuB. Медь связана с цитохромом a3 (хоть на рисунке это и не видно).
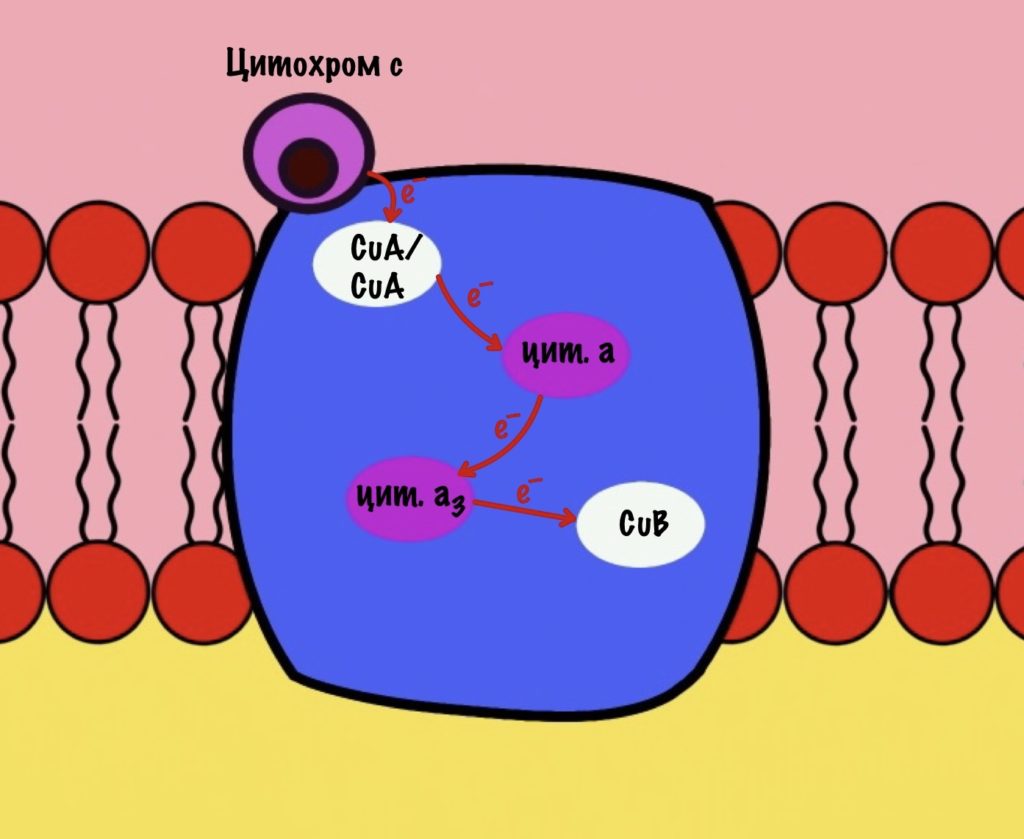
Цитохром c присоединяется к четвёртому комплексу и передаёт свой электрон на CuA/CuA. Далее атомы меди отдают электрон на цитохром a, а тот на цитохром a3. Они могут принять только по одному электрону — там одно железо +3. Цитохром a3 скидывает электрон на CuB. Медь меняет степень окисления — переходит из +2 в +1.
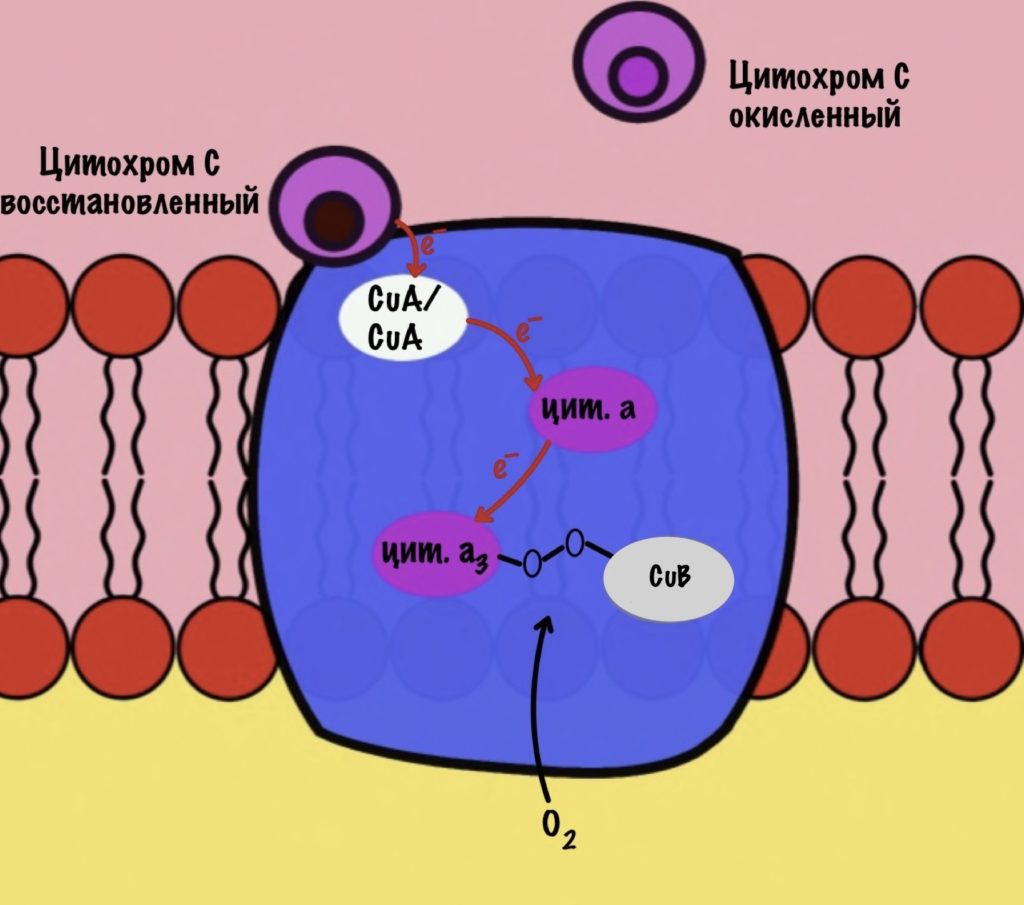
Дальше присоединяется второй цитохром c. Повторяется всё, что я написал выше. Но электрон не может попасть на CuB, потому что она уже +1, а больше электронов принять не может. Поэтому электрон останавливается на цитохроме a3. Теперь цитохром a3 и ион меди +1 могут связаться с кислородом — формируется пероксидный мостик. Кислород поглощает два электрона: один с цитохрома a3, а другой с CuB.
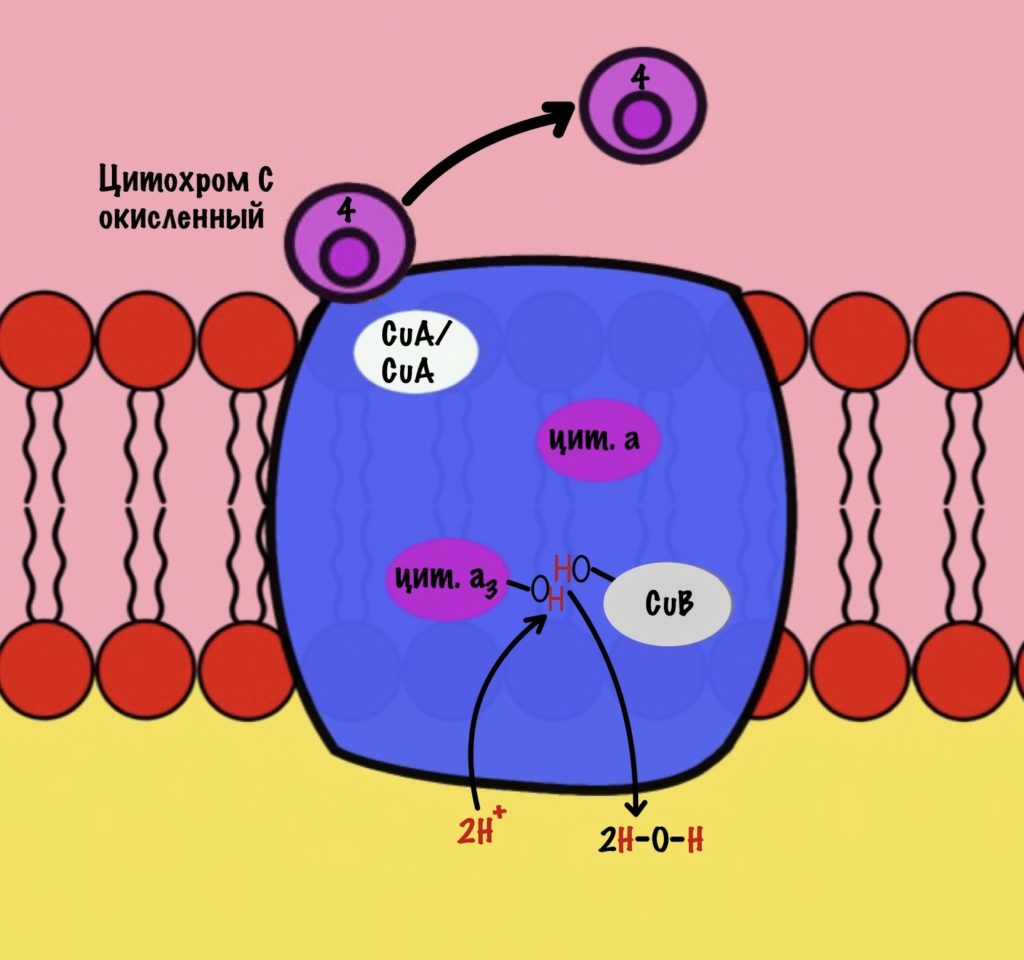
Присоединяется третий цитохром c. У меня ощущение, что я рассказываю анекдот с затянутой концовкой. Этот электрон используется для того, чтобы разрушить пероксидный мостик между железом и медью. Но нужен не только электрон, но и протон — он берется из матрикса митохондрии. Это приводит к разрушению пероксидного мостика. Остаётся цитохром а3, который связан с кислородом, и медь с гидроксильной группой.
Присоединяется четвёртый электрон от цитохрома с, а один протон берется из матрикса. Это приводит к образованию гидроксильной группы на цитохроме а3.
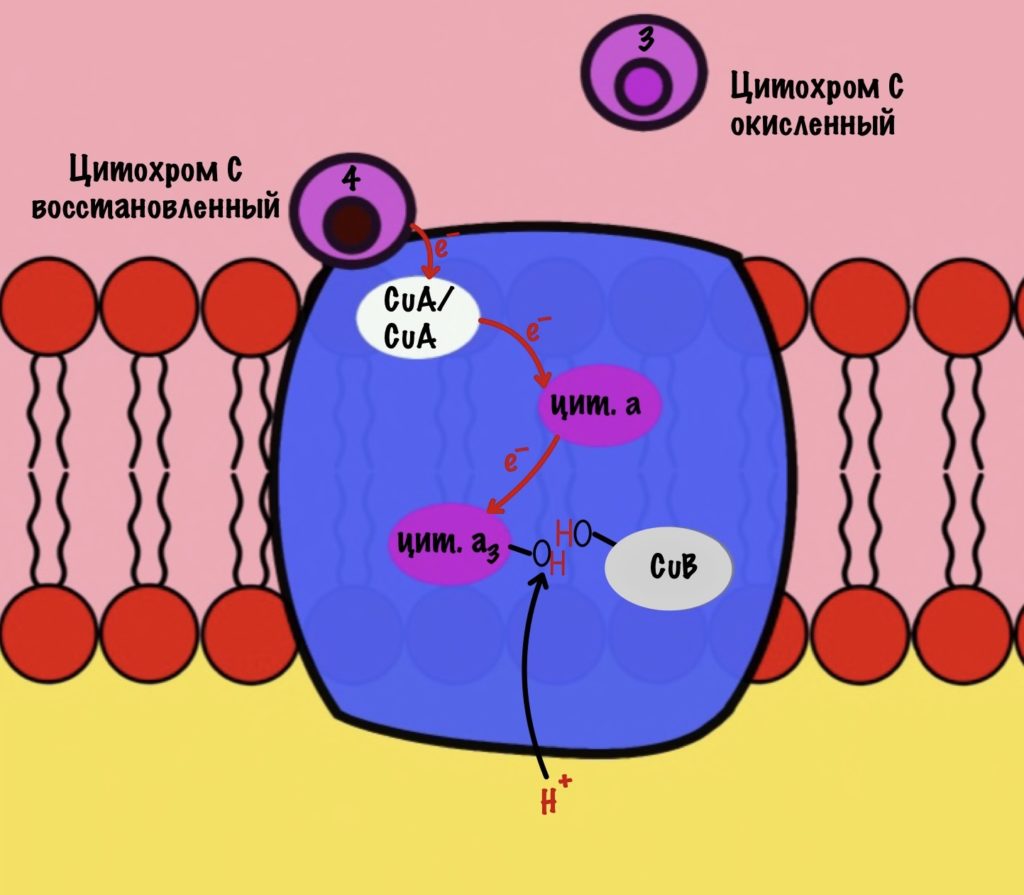

Из матрикса берутся ещё два протона — это приводит к образованию двух молекул воды. При этом цитохром а3 и медь возвращаются в свою начальную форму.
Обсудим, что у нас вышло. Мы присоединили четыре электрона к четвёртому комплексу, а также взяли из матрикса четыре протона водорода и кислород. В итоге мы получили две молекулы воды, да ещё избавились от опасных электронов. Они могут много чего натворить в клетке. Энергия окислительно-восстановительных реакций одного электрона используется на транспорт одного протона из матрикса в межмембранное пространство. Всего использовали четыре электрона — четыре протона вылетело в межмембранное пространство.
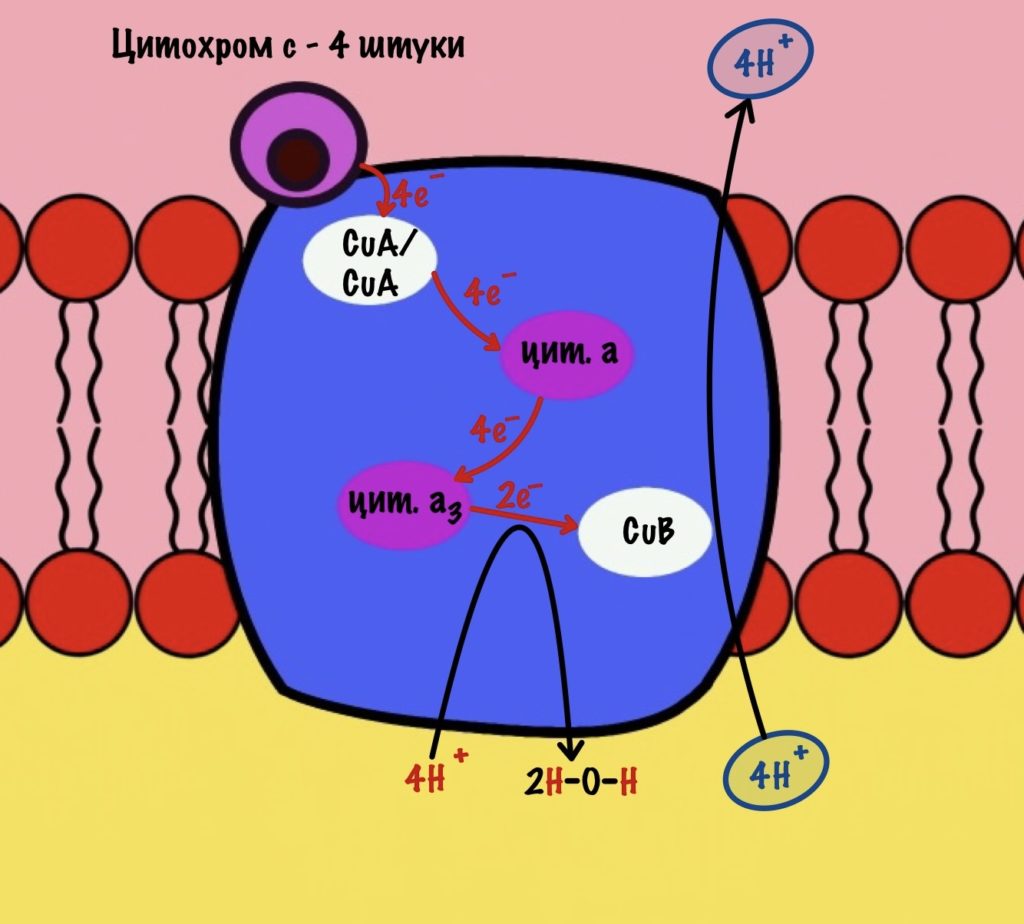

Воспоминаем, что до этого мы использовали только по два электрона во всех комплексах. Да и НАДH и ФАДH2 несли себе всего по два электрона. Не проблема, просто поделим всё на два. И у нас получится:
Четвёртый комплекс переносит два электрона на 1/2 кислорода — образуется молекула воды. Энергия восстановительных реакций используется для транспорта двух протонов водорода.
Общий подсчёт: сколько протонов транспортируется из матрикса за счёт двух электронов?
В ходе работы первого комплекса были транспортированы 4 протона. Третьего — 4 протона. А четвёртого — 2 протона. Второй комплекс протоны не транспортирует. Первый комплекс присоединяет НАДH, а второй — ФАДH2. Второй комплекс передаёт электроны на третий комплекс, пропуская первый. Получается, что энергия электронов одной молекулы НАДH используется на транспорт 10 протонов. А энергия электронов одной молекулы ФАДH2 на транспорт 6 протонов.
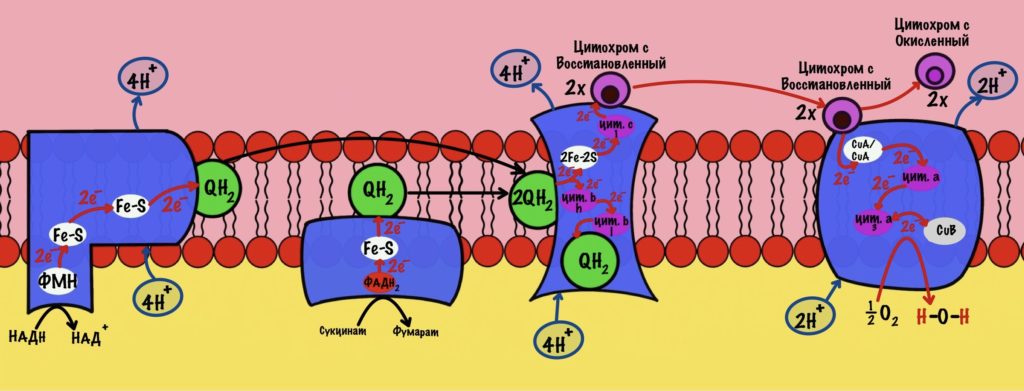

Энергия электронов 1 НАДH идёт на транспорт 10 протонов.
Энергия электронов 1 ФАДH2 идёт на транспорт 6 протонов.
Теперь нам нужно превратить эти протоны в энергию.
АТФ-синтаза
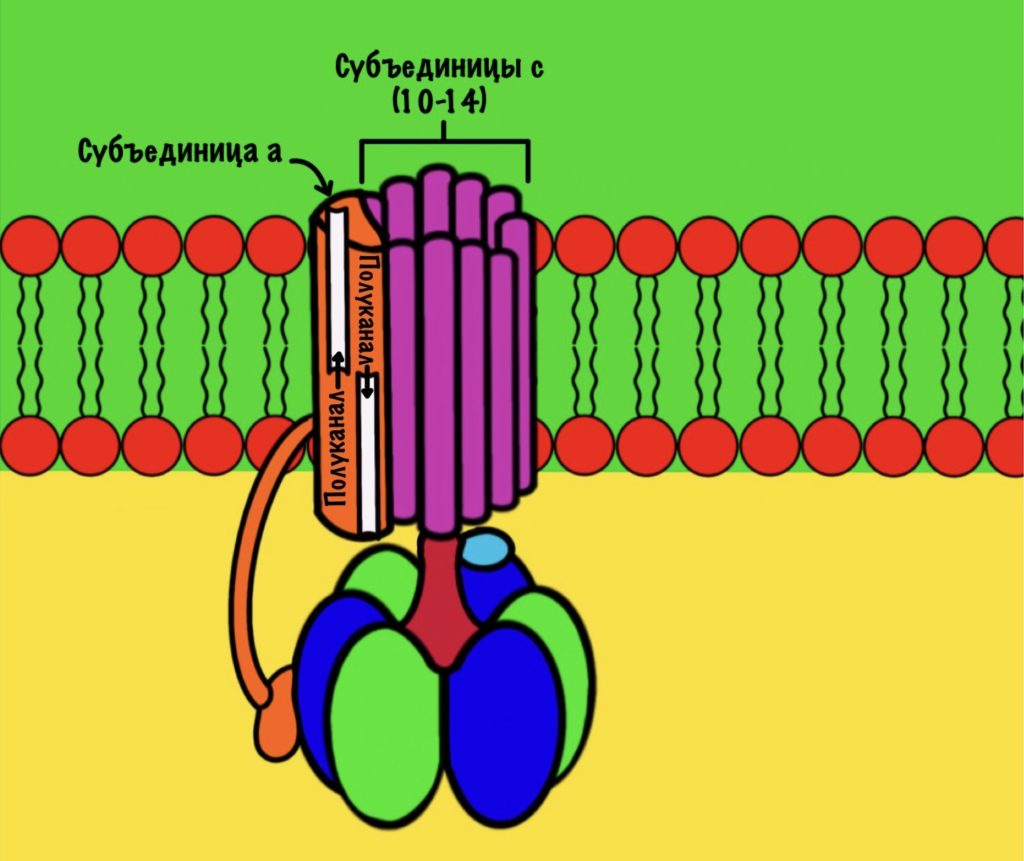
АТФ-синтаза — это фермент, который состоит из двух больших частей (или доменов): Fо и F1. Fо — это протонная помпа, которая встроена в мембрану. Если перевести название на русский — олигомицин-чувствительная фракция (часть). F1 — это каталитический домен, который синтезирует АТФ. F1 — первая фракция (часть).
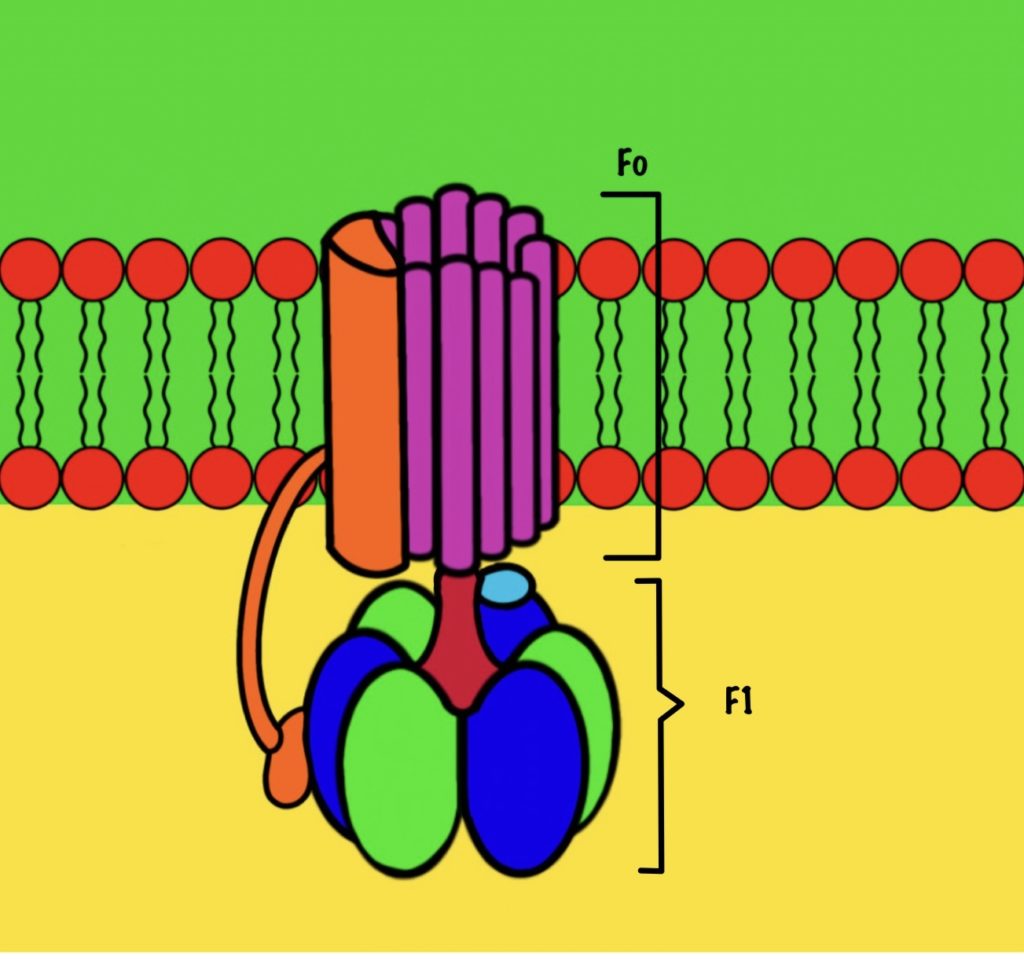

F0 домен состоит из 10-14 субъединиц c и одной субъединицы a. C субъединицы образуют жёсткое кольцо — оно вращается, когда присоединяет протон водорода. В субъединице a есть полуканалы для протонов. Именно полуканалы, а не целые. Один полуканал связан с межмембранным пространством, а второй с матриксом. Они отделены друг от друга.
F1 домен состоит из пяти типов полипептидных цепей — альфа, бета, гамма, эпсилон и дельта. Три альфы и три беты образуют гексамер — похож на клевер. Он ответственен за синтез АТФ. Этот гексамер связан с 10-14 субъединицами с с помощью гамма и эпсилон цепей. Две эти цепи образуют ножку, которая вращается вместе с субъединицами c. Наибольшая роль здесь у гамма субъединицы. Вы можете подумать, что эта ножка будет вращать гексамер, но это не так! Гексамер всегда остаётся на месте, а вертится только ножка и субъединицы c.
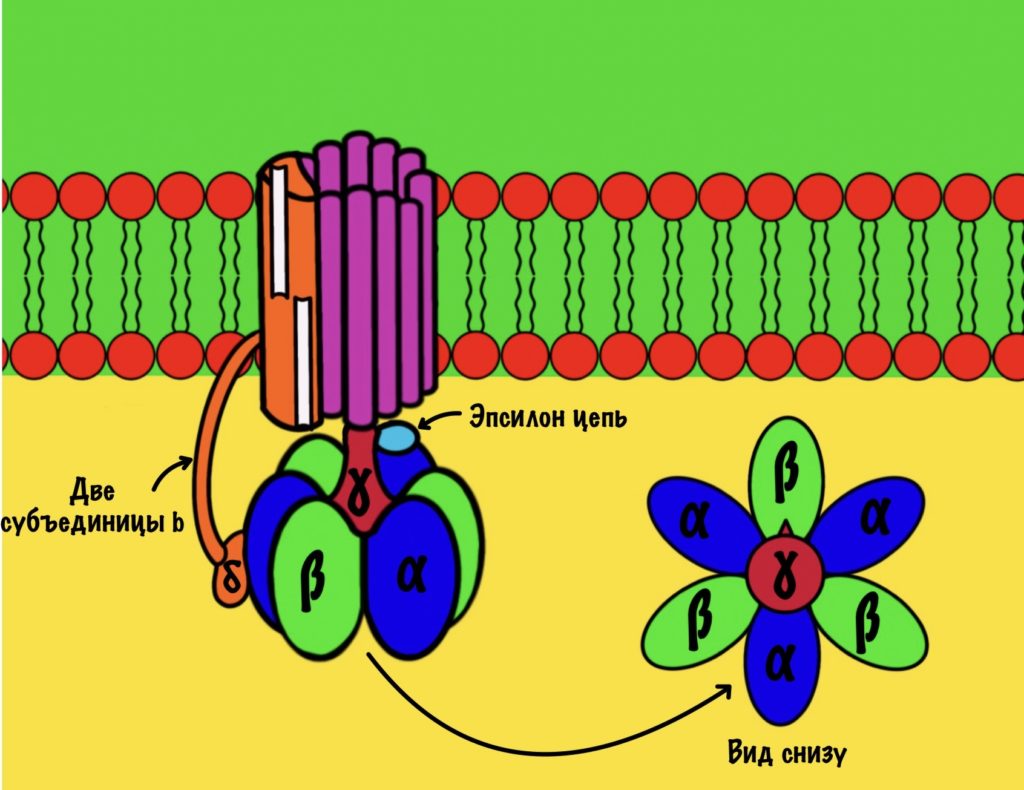

Дельта субъединица стабилизирует гексамер, она не даёт ему развалиться и вращаться вместе с ножкой. Ещё есть две субъединицы b, которые связывают между собой субъединицу a и субъединицу дельта.
Fо и F1 регион связаны через:
- Гамма ножку и эпсилон полипептидную цепь;
- Субъединицы b, которые связывают субъединицы a и дельта.
АТФ синтаза состоит из двух регионов:
- Вращательного — кольцо из субъединиц c и ножки гамма-эпсилон;
- Стационарного: гексамер из 3-альфа и 3-бета цепей, субъединицы a и b, а также дельта-субъединицы.
Регион F1
Начнём с него, а потом перейдём к вращению нашего кольца. Нас интересует гексамер, который участвует в синтезе АТФ. Гексамер состоит из трёх альфа и трёх бета цепей.
При этом альфа цепи всегда связаны с АТФ и не участвуют в его синтезе, поэтому они нас не интересуют. А вот бета цепи ответственны за:
- Связывание АДФ и неорганического фосфата;
- Синтез АТФ;
- Высвобождение АТФ.
Только один из этих процессов связан с вращением c-кольца, угадаете какой? Нет — это не синтез АТФ. Удивительно, но каждая из бета-цепей легко синтезирует АТФ. Они настолько сближают АДФ с фосфатом, а также создают гидрофобное окружение вокруг них, что реакция синтеза АТФ идёт без каких-либо проблем и затрат энергии. А вот высвободить образованную АТФ эти субъединицы не могут, они имеют слишком большое сродство к ней. Поэтому, если мы сравним обычную ферментативную реакцию с получением АТФ, то увидим такое…
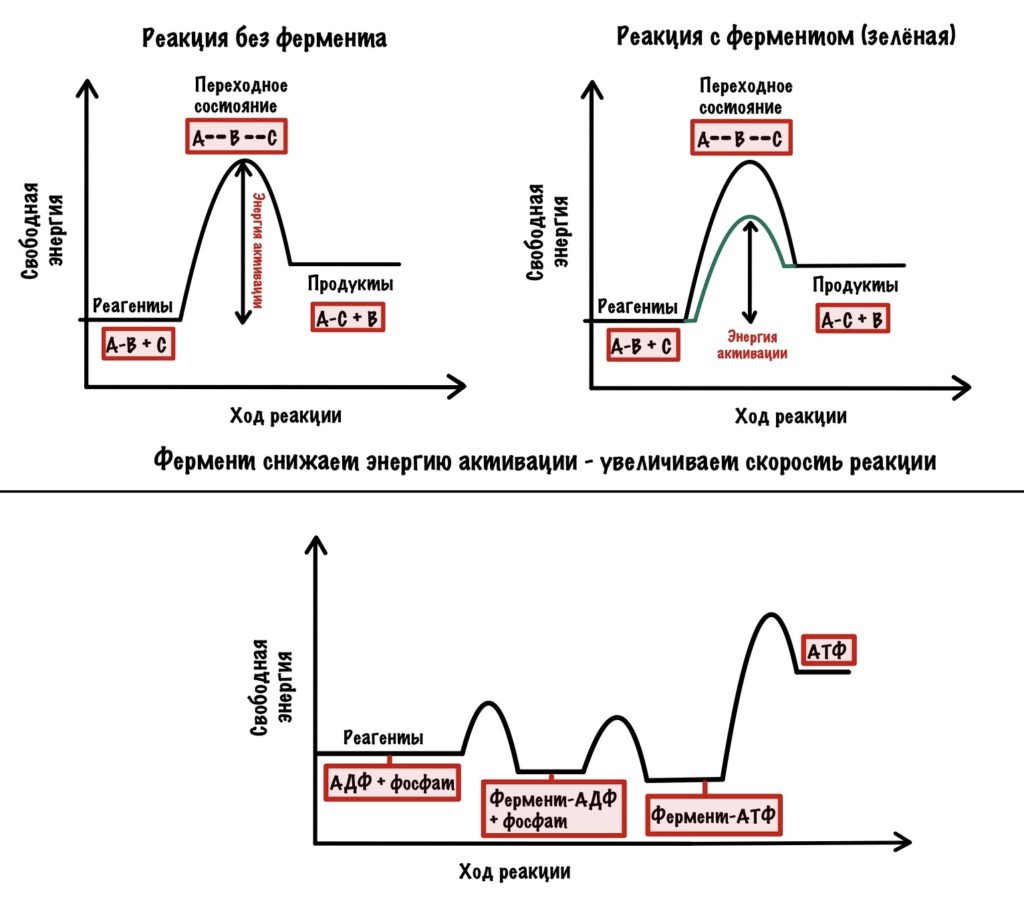

Видите? В образовании АТФ из АДФ и фосфата почти нет изменения свободной энергии, в отличие от ферментативной реакции. Но сколько нужно энергии для её высвобождения — жуть! Для того, чтобы высвободить АТФ нужно вращение, создаваемое c-кольцом. Вращение предоставляет энергию для высвобождения АТФ. Оно вызывает конформационные изменения в бета-субъединицах, благодаря которому они выпускают АТФ из своих лап.
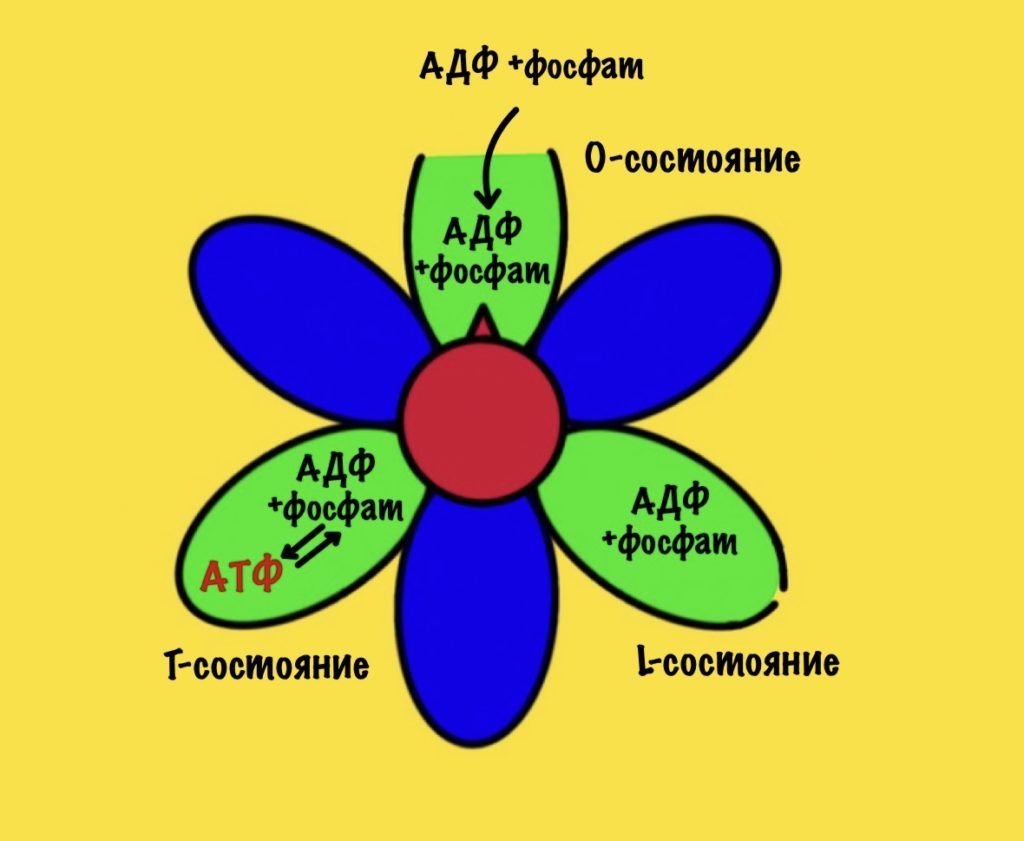
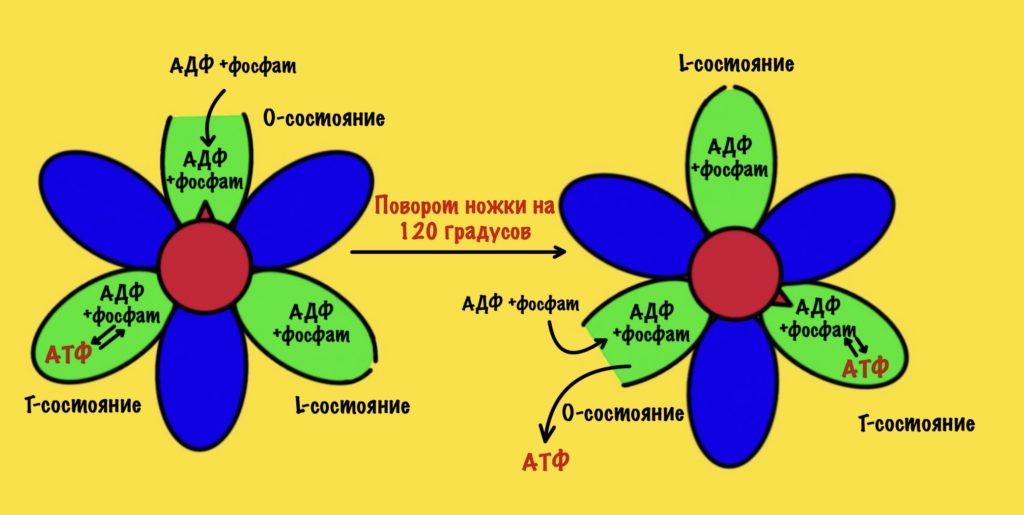
Вернёмся к бета-цепям. Они могут быть в трёх состояниях: open, loose и tense (открытое, свободное и напряжённое). Или O, L и T состояния. В O-состоянии бета-субъединица присоединяет АДФ и неорганический фосфат. В L-состоянии бета закрывает фосфат и АДФ в ловушку — они не могут выбраться из субъединицы. В T-состоянии синтезируется АТФ, которая не может отсоединиться от фермента из-за его высокого сродства.
В АТФ-синтазе каждая из бета-субъединиц находится в одном из этих состояний. Одна в O, другая в L, а третья в T. Вращение гамма ножки вызывает переход бета-субъединицы из одного состояния в другое. Получается, что любые две бета-субъединицы не могут существовать в одном состоянии одновременно.
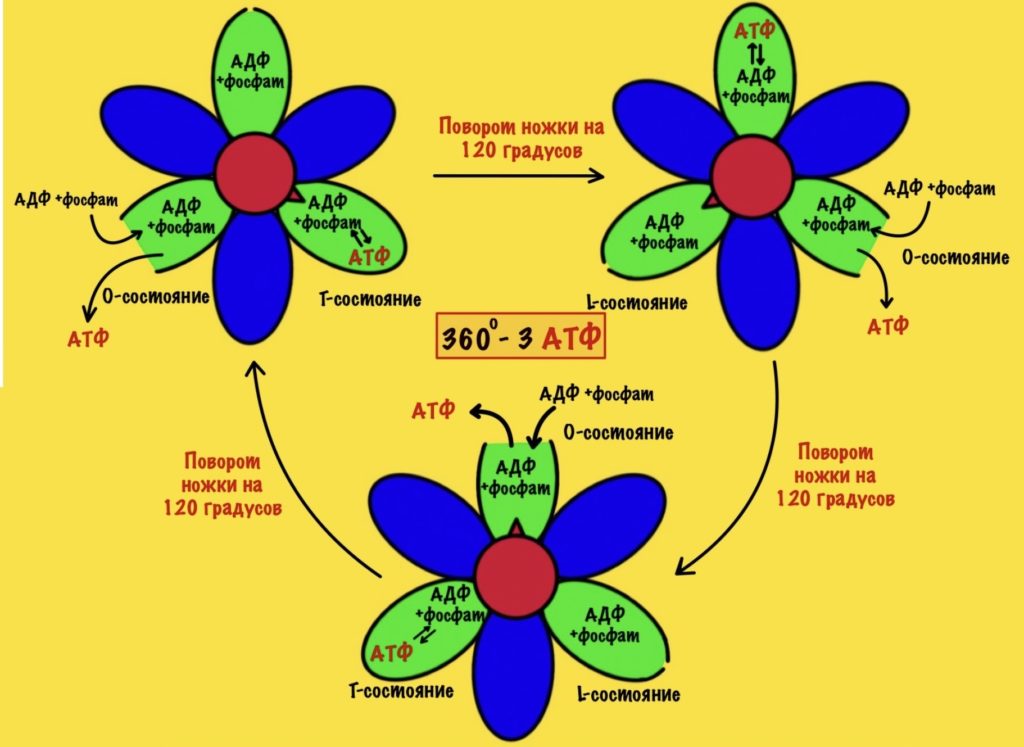
Ножка вращается на 120 градусов по часовой стрелке (если смотреть снизу). Это вызывает конформационные изменения в субъединицах, что приводит к переходу из одного состояния в другое. При этом одна бета-субъединица переходит из O-состояния в L. Вторая из L-состояния в T. А третья из T-состояния в O. В О состоянии бета-субъединица отсоединяет АТФ, а потом связывается со следующим АДФ и неорганическим фосфатом.
Давайте сделаем полный круг вращения. 360 градусов — это три поворота для нашей ножки. Каждая субъединица изменит свое состояние три раза. Получается, что в ходе такого вращения будет синтезировано три молекулы АТФ.
Регион Fo
Теперь нужно понять механизм вращения ножки. Субъединица a связана с кольцом из 10-14 субъединиц c. Напоминаю, что в а-субъединице есть полуканалы для протонов.
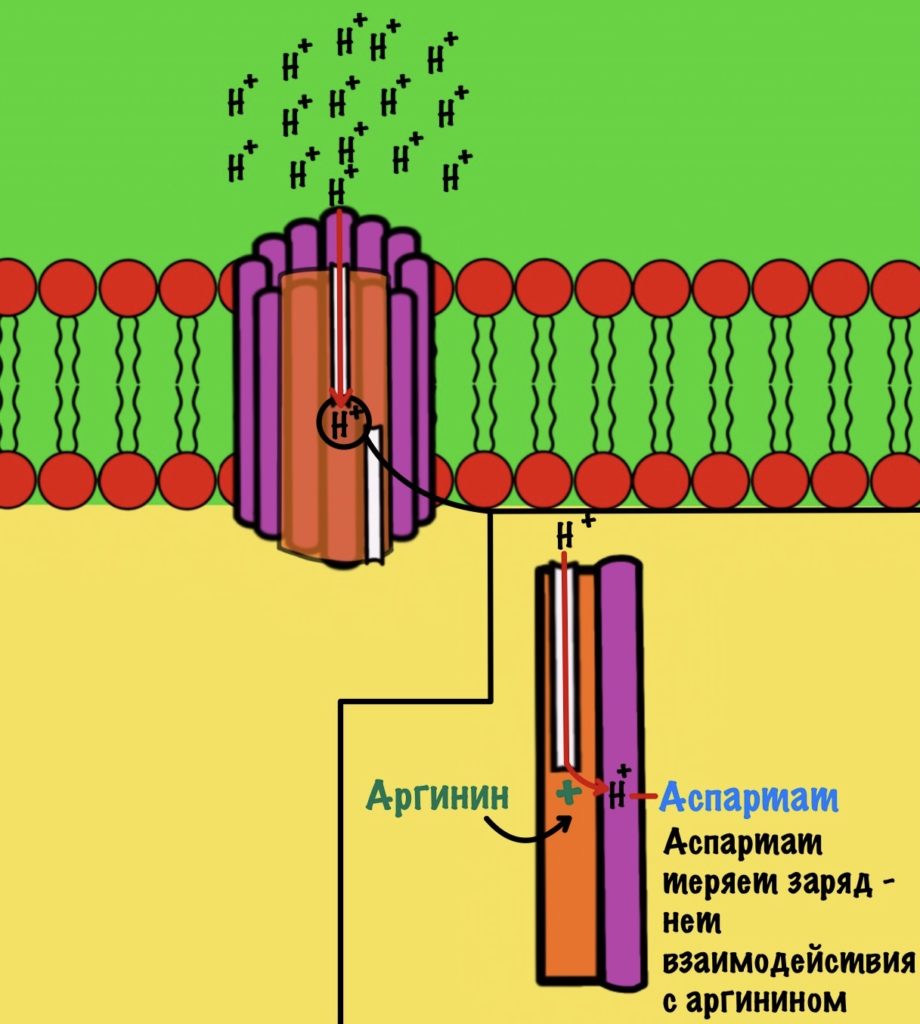
Если посмотреть на этот полуканал, то мы увидим кое-что интересное. В конце полуканала находится аргинин от субъединицы a. Это положительно-заряженная аминокислота. Аргинин взаимодействует с аспартатом из субъединицы c. Аспартат — это отрицательно-заряженная аминокислота. Аспартат и аргинин взаимодействуют, как разноимённо-заряженные частицы. Немного разверну рисунок для удобства.
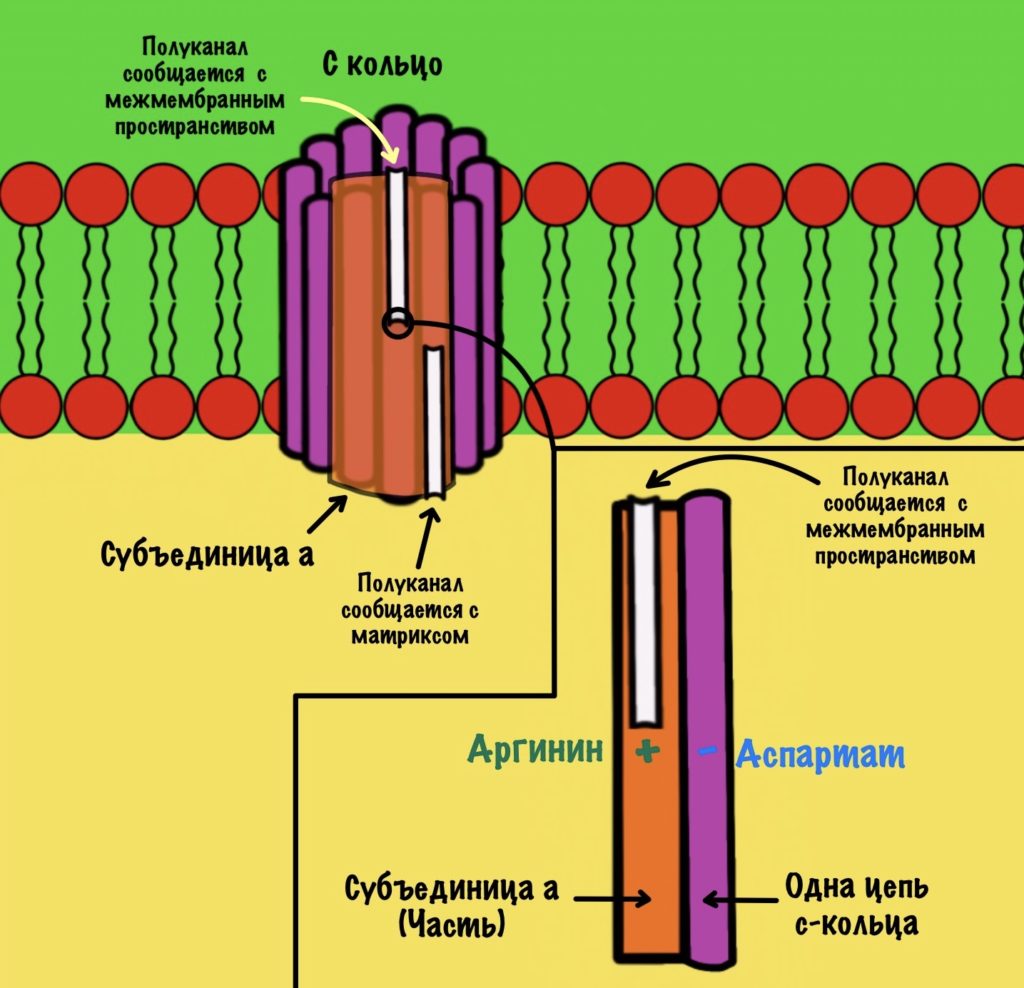

Протон пролетает через полуканал а субъединицы и присоединяется к аспартату. Из-за того, что у аспартата отрицательный заряд, а у протона положительный. Аспартат и аргинин перестают взаимодействовать друг с другом, так как аспартат потерял свой отрицательный заряд.
Это приводит к вращению всего кольца субъединиц c по часовой стрелке — на одну субъединицу c. При этом вращается и ножка гамма-эпсилон, что приводит к конформационным изменениям в гексамере. Ну это тот,который синтезирует АТФ.
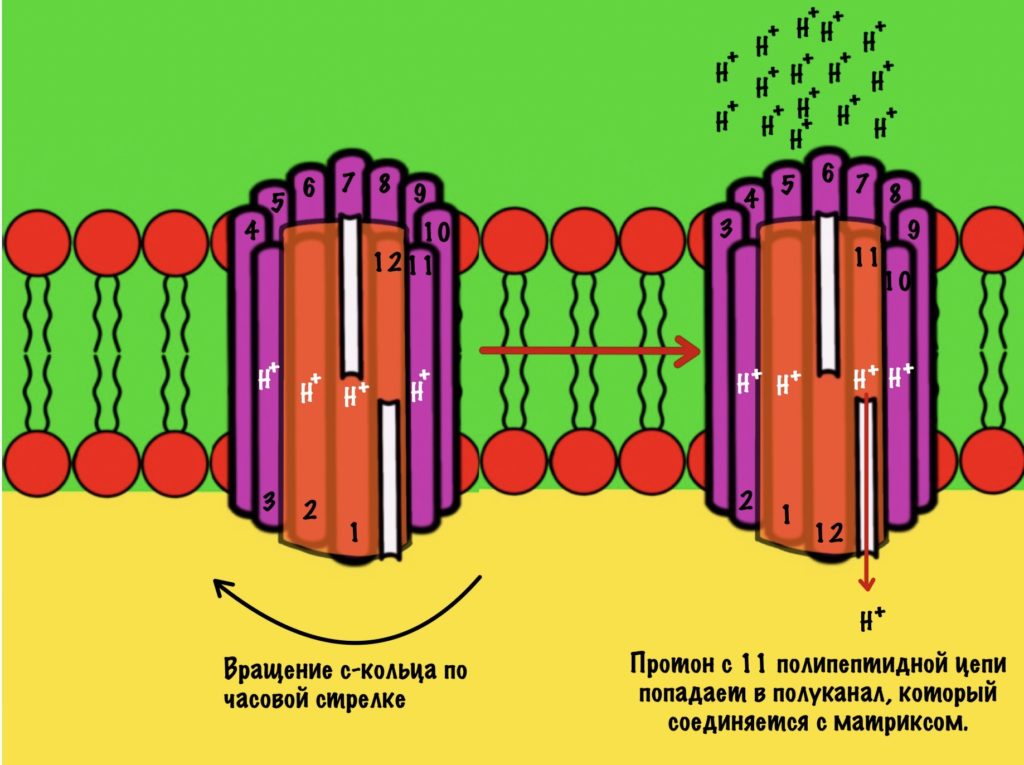

11 субъединица взаимодействует с каналом, который соединяется с матриксом. Аспартат этой субъединицы отдаёт протон водорода — он попадает в матрикс. Дальше 12 субъединица присоединит протон из межмембранного пространства, что приведёт к следующему вращению кольца. Теперь 11 субъединица присоединит протон и так далее… Удивительно, но природа придумала двигатель так давно!
Если мы хотим провести полное вращение c кольца — 360 градусов, то нам нужно присоединить к каждой субъединице с по одному протону. Так и происходит. Помните, что в кольце от 10 до 14 c субъединиц? Значит на полное вращение нам понадобится 10-14 протонов. В моём вот было 12 полипептидных цепей, значит для полного круга нужно присоединить 12 протонов.
При этом произойдёт полное вращение ножки — три раза по 120 градусов. Значит каждый гексамер изменит своё состояние три раза — три поворота по 120 градусов. Получается, что одно полное вращение с кольца, а с ним и ножки, приводит к синтезу трёх молекул АТФ.
Сколько протонов нужно для синтеза одной молекулы АТФ?
10-14 протонов на одно вращение на 360 градусов = 3 молекулы АТФ
Получается, что для синтеза одной молекулы АТФ нужно от 3,33 до 4,66 протонов. Или в среднем — 4 протона.
Для синтеза одной молекулы АТФ нужно 4 протона.
При транспорте электронов с НАДH было получено 10 протонов = 2,5 молекулы АТФ.
При транспорте электронов с ФАДH2 было получено 6 протонов = 1,5 молекулы АТФ.
Так что теперь вы не поведётесь на то, что пишут в некоторых учебниках: «Из одного НАДH синтезируется 3 молекулы АТФ, а из одного ФАДH2 — 2 молекулы АТФ. Поздравляю!
Нарушение работы окислительного фосфорилирования
Ух, ну и системку мы разобрали. Согласитесь, что она очень сложная. Но при этом отлично справляется со своей работой — в норме. Но давайте немного отойдём от нормы. Время поиграть в доктора!
Представьте себе, что у пациента анемия — снизились эритроциты и/или гемоглобин. Меньше кислорода поступает в ткани и органы, а значит в митохондриях дела плохи. Электроны не могут попасть на свой финальный акцептор — кислород. Электроны застревают в комплексах дыхательной цепи. Они не создают градиент концентрации, поэтому нет синтеза АТФ. Пациент с анемией чувствует общую слабость именно из-за этого.
В организме истощился запас железа. Тут два патологических механизма. Дефицит железа приводит к снижению гемоглобина, а дальше вы уже знаете. Железо идёт не только на синтез гемоглобина, но и цитохромов — компонентов третьего и четвёртого комплекса дыхательной цепи. Если нет акцепторов электронов, то нет и окислительного фосфорилирования.
Дефицит меди. Медь входит в четвёртый комплекс дыхательной цепи, поэтому если её не будет, то комплекс перестанет работать.
Дефицит белка в рационе или нарушение его всасывания. Причин множество, но нас они не интересуют. Белок используется для синтеза собственных белков организма — ферментов и комплексов дыхательной цепи.
Гиповитаминозы. Коснёмся только двух, хотя почти каждый гиповитаминоз будет приводить к нарушениям. НАД+ и ФАД — это производные витаминов. НАД+ — никотиновой кислоты (витамин B3). ФАД — рибофлавина (витамин B2). Если словить два этих гиповитаминоза, то у нас просто не будет начальных акцепторов электронов. Так что электрончики не смогут запрыгнуть на дыхательную цепь с НАДH и ФАДH2.
Дефицит углеводов и липидов в рационе/нарушение их всасывания. Тут всё понятно, если нет субстратов, то откуда взять электроны?
Разобщители окислительного фосфорилирования
Мы договорились, что работа дыхательной цепи сопряжена с синтезом АТФ. Но есть молекулы, которые разобщают эти два процесса. Как? Разобщители — это жирорастворимые молекулы, которые могут проходить через внутреннюю мембрану митохондрий. Но если бы они только проходили! Эти молекулы присоединяют к себе протоны, а потом переносят их в матрикс митохондрии. Они мешают митохондрии создать градиент концентрации протонов, который так важен для синтеза АТФ.
В итоге получается так, что дыхательная цепь работает, но синтеза АТФ нет. Энергия транспорта электронов рассеивается в виде тепла. Я хочу, чтобы вы помнили о разобщителях, которые встречаются в нашем организме: жирных кислотах, неконъюгированном билирубине и трийодтиронине. Это не значит, что в норме они сильно влияют на работу окислительного фосфорилирования. Но при патологических состояниях…
У пациента с ожирением в крови повышается количество жирных кислот. Чем больше жирных кислот, тем больше шанс, что они попадут в митохондрии и повлияют на окислительное фосфорилирование.
Некоъюгированный билирубин повышается при гемолизе эритроцитов или нарушениях функции печени. Его накопление приводит к разобщению работы дыхательной цепи и синтеза АТФ. Представьте какую слабость чувствует пациент при гемолизе эритроцитов — в митохондрии не попадает кислород, да ещё непрямой билирубин вызывает разобщение окислительного фосфорилирования. Мрак.
Трийодтиронин повышается при тиреотоксикозе. Поэтому эти пациенты чувствуют жар и быстро теряют в весе — энергия переноса электронов рассеивается в виде тепла.
Мы и сами можем вызывать разобщение, назначив дикумарин — антикоагулянт непрямого действия. Его побочный эффект — это разобщение окислительного фосфорилирования.
Подсчёт АТФ: сколько молекул можно получить с помощью окислительного фосфорилирования?
Теперь, когда мы понимаем все механизмы, можно подсчитать сколько АТФ было получено в ходе катаболизма одной молекулы глюкозы.
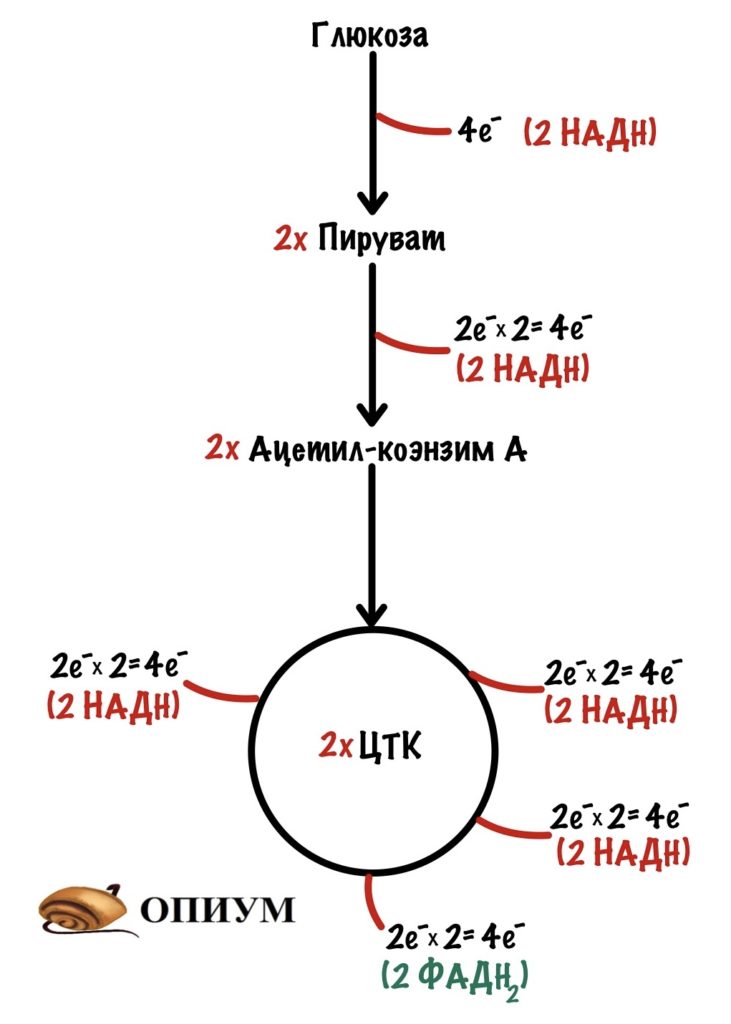


В ходе гликолиза было получено две молекулы НАДH. Они транспортируются в матрикс митохондрий — ведь гликолиз шёл в цитоплазме. Для этого используются челночные механизмы. Глицеролфосфатный челнок переносит электроны с НАДH на ФАД — образуется ФАДH2. Малат-аспартатный переносит электроны на митохондриальный НАД+ — переходит в НАДH. Теперь понимаете, почему это важно? Будет получено разное количество АТФ.
Остальные восстановленные коферменты уже находятся в митохондрии, поэтому их электроны можно сразу отправить на дыхательную цепь. Допустим, что мы использовали малат-аспартатный челнок, тогда в матриксе митохондрии находятся: 10 молекул НАДH и 2 молекулы ФАДH2.
10 х 2,5 АТФ + 2 х 1,5 АТФ = 28 молекул АТФ.
Если мы использовали глицеролфосфатный челнок, то в матриксе находятся: 8 молекул НАДH и 4 молекулы ФАДH2.
8 x 2,5 АТФ + 4 х 1,5 АТФ = 26 молекул АТФ.
В ходе окислительного фосфорилирования из одной молекулы глюкозы синтезируется 28 или 26 молекул АТФ.
Но это не общий выход катаболизма глюкозы, потому что в нём были и другие реакции синтеза АТФ — субстратного фосфорилирования. Если вспомнить гликолиз, то там были две таких реакции.
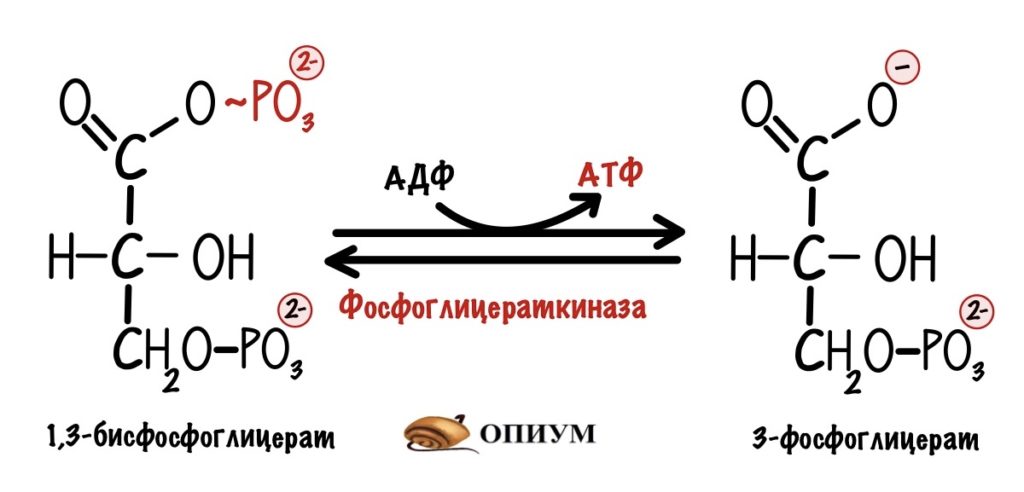
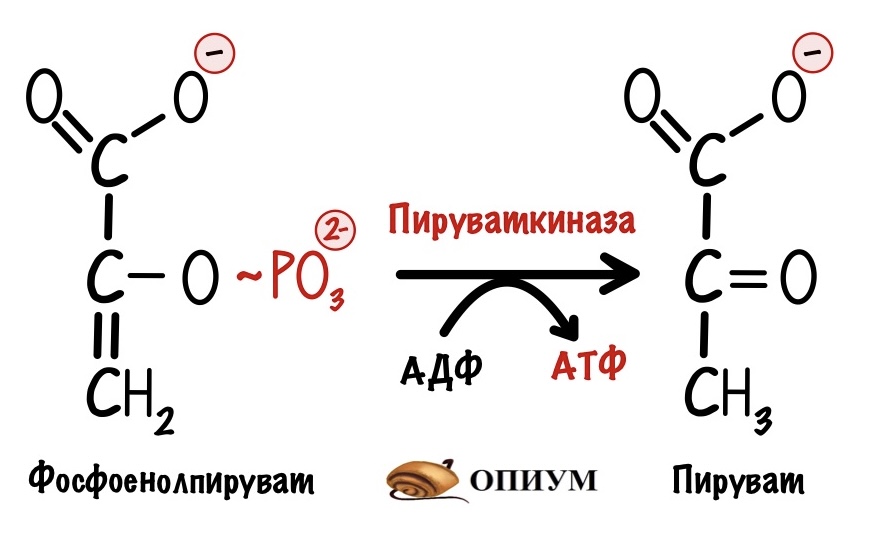
И вот вторая:
Мы видим, что из одной триозы образуется ещё 2 молекулы АТФ. Но в ходе гликолиза были образованы две триозы, поэтому всего там было получено 4 молекулы АТФ. Но это ещё не всё…
На активацию молекулы глюкозы мы затратили 2 молекулы АТФ — первая и третья реакции гликолиза.
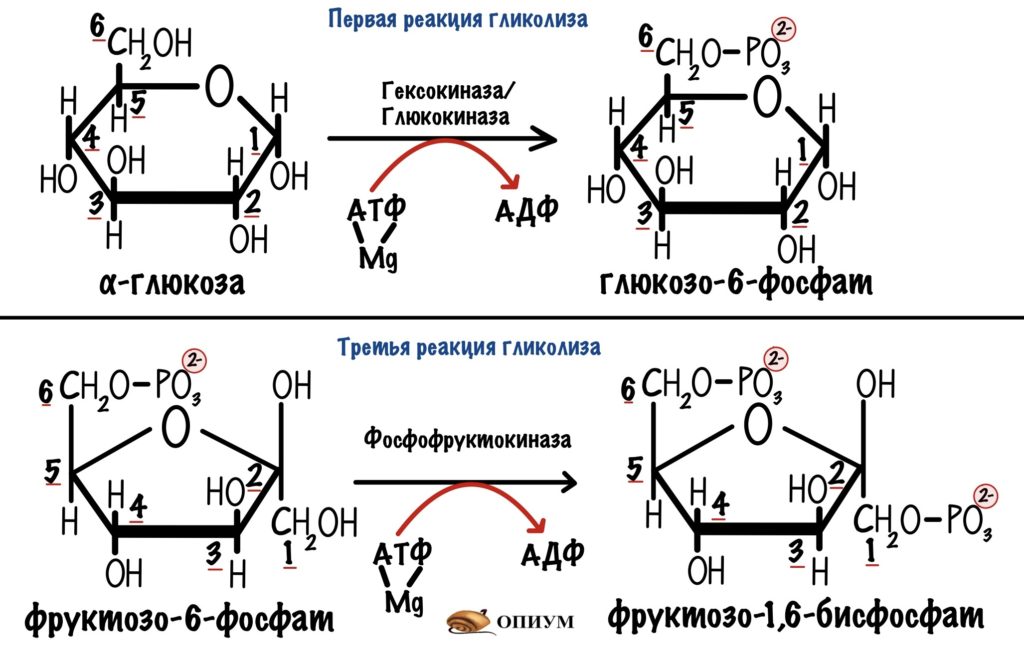

Так что общий выход гликолиза — 2 молекулы АТФ. Но и это ещё не всё!
Вспоминаем цикл трикарбоновых кислот, где были получены ещё две молекулы ГТФ. ГТФ равно АТФ, так как можно легко их переводить друг в друга.


Сделаем общий подсчёт. Гликолиз = 2 АТФ и 2 НАДH. Окислительное декарбоксилирование пирувата = 2 НАДH. ЦТК = 6 НАДH + 2 ФАДH2 + 2 ГТФ (АТФ). Итого:
2 АТФ + 10 НАДH + 2 ФАДH2 + 2 ГТФ (АТФ) = 2 + 25 + 3 + 2 = 32 молекулы АТФ
Это для малат-аспартатного челнока. Если будет использован глицеролфосфатный, то:
2 АТФ + 8 НАДH + 4 ФАДH2 + 2 ГТФ (АТФ) = 2 + 20 + 6 + 2 = 30 молекул АТФ
Из одной молекулы глюкозы образуется 32 молекулы АТФ, либо 30. Всё зависит от челнока, который был использован клеткой.