Сигнальные молекулы
В статье о ферментах мы пояснили за их регуляцию. Было два варианта: быстрая и медленная. В быструю входит: аллостерическая регуляция, ассоциация и диссоциация, фосфорилирование и дефосфорилирование. Я опускаю ограниченный протеолиз, потому что с нашей темой он не клеится. В медленную — действие на ДНК клетки с запуском синтеза фермента. Напоминаю разницу, быстрая действует мгновенно, а медленная может длиться часами. Синтез новой молекулы требует времени, обычно от нескольких часов до суток.
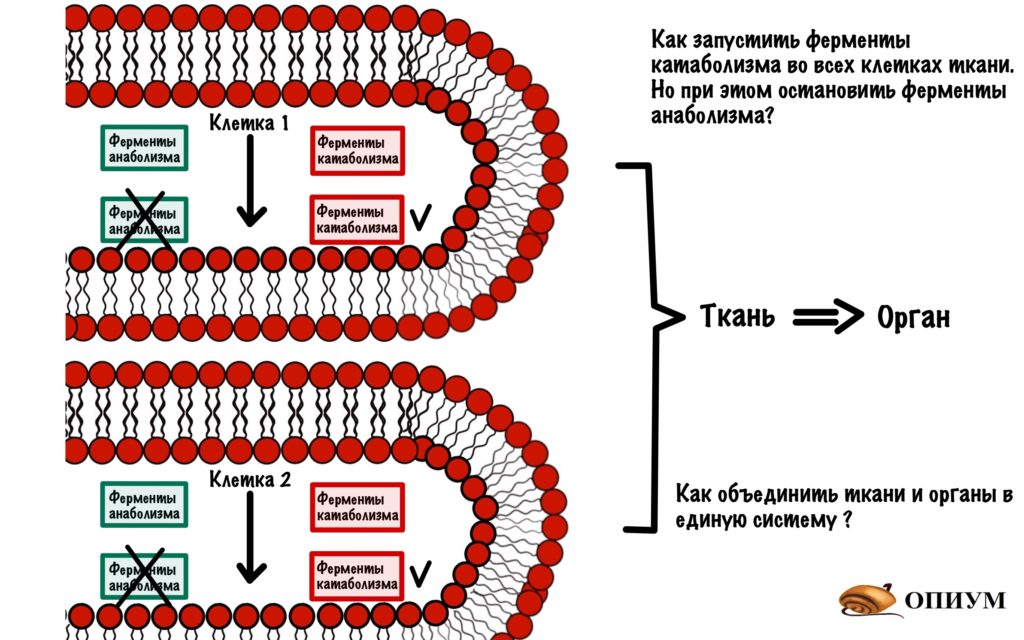
Тут появляется проблемка, мы можем включить или выключить фермент. Но в клетке не один фермент, а множество. Одни отвечают за катаболизм, а другие за анаболизм. И это только одна клетка! А над ней стоят ткани и органы. И вся эта система должна работать сообща, а не как получится.
Если твоему организму понадобится энергия, то он запустит катаболизм. Но при этом остановит анаболизм. Чтобы получить какой-то выхлоп по энергии — организму нужно запустить катаболизм и остановить анаболизм в большинстве клеток, а не в какой-то одной.
Это можно сделать через сигнальные молекулы.
Что такое сигнальные молекулы?
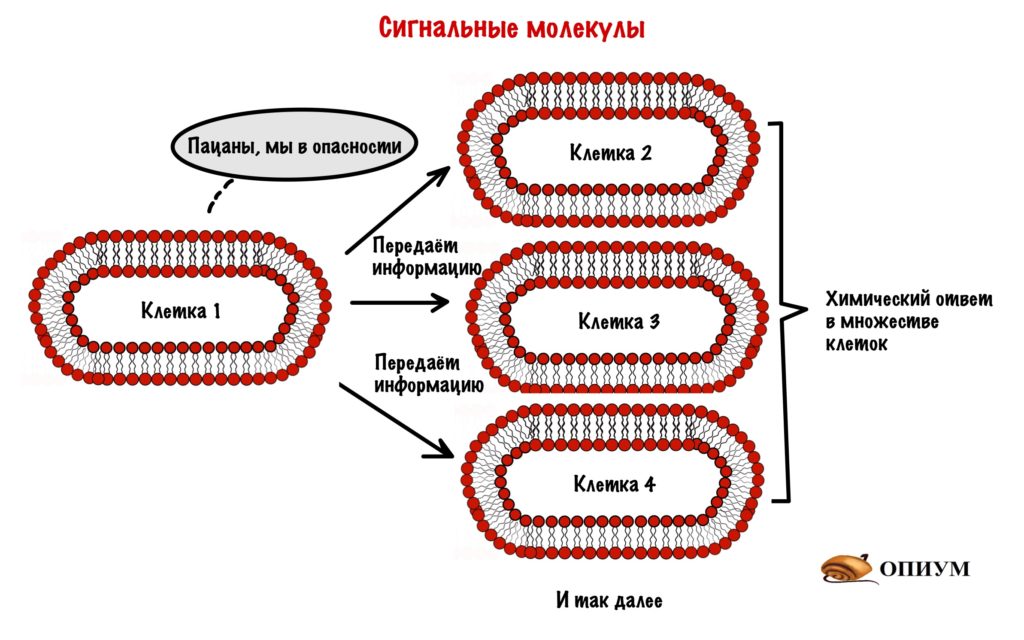
Это молекулы, которые передают сигнал от одной клетки к другим клеткам. Очень удобно: одна клетка может влиять сразу на множество клеток. Через сигнальные молекулы организм образует единую систему. И судя по тому, что мы ещё живы — она даже рабочая.
К сигнальным молекулам относятся: гормоны, цитокины, факторы роста и нейромедиаторы. Это самая простая классификация, но за ней скрывается многое. Просто по приколу перечислю гормоны, которые придут в голову: АКТГ, инсулин, глюкагон, адреналин, кортизол, ТТГ, Т3 и Т4, ангиотензин II, натрийуретический пептид и так далее. Если вспоминать нормально, то можно накинуть ещё кучу других. А цитокины? Их тоже милльйон: факторы некроза опухолей, интерлейкины, интерфероны и другие. И это только классы, а в них этих цитокинов….
Пытаюсь испугать вас масштабом этой системы. Можно подумать, что сигнальные молекулы будут действовать по разным механизмам. Удивительная штука, но вся эта группа молекул действует всего по четырём механизмам.
К ним относятся действие через: рецепторы, связанные с G-белком; рецепторы с ферментативной активностью и ядерные рецепторы. Не хватает четвёртого. Это действие на ионные каналы — с их открытием или закрытием. В этой статье мы не будем трогать каналы, но там ничего сложного нет. Отвечаю.
Про каждый тип рецептора будем говорить подробнее чуть ниже, а пока выделим общее для них.
Принципы действия сигнальных молекул
Мы уже знаем, что сигнальная молекула передаёт сигнал от одной клетки к другим клеткам. Этот сигнал несёт информацию — она может быть любой. Если мы видим разъярённого медведя, то адреналин передаёт информацию об опасности другим клеткам. Ребята, нам пора бежать — давайте энергию и кислород мышцам! Если в крови много глюкозы, то инсулин передаёт информацию об этом другим клеткам. Пацаны, пора убрать глюкозу или вы в гипергликемическую кому захотели?
Эта информация вызывает в клетках определённый ответ. Этот ответ всегда связан с химическими изменениями! Ответом может быть разрушение гликогена до глюкозы (гликогенолиз), а может быть синтез белка. А иногда клетка просто поменяет концентрацию ионов в цитоплазме. Но суть одна — в клетке происходят химические изменения!
Сигнальная молекула передаёт информацию другим клеткам. Эта информация вызывает химический ответ в этих клетках.
Как молекула передаёт информацию?
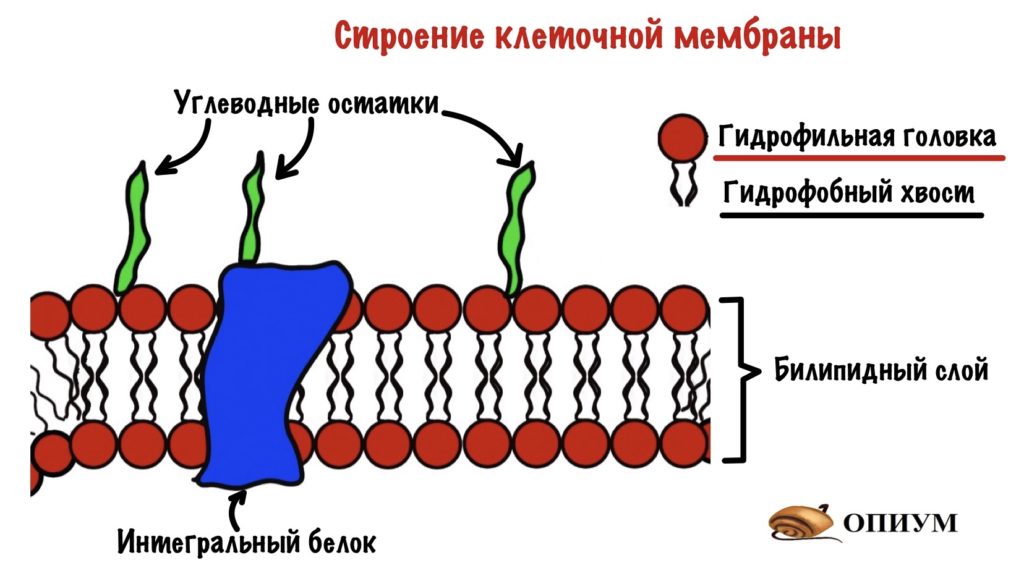
Клетка окружена клеточной мембраной — через неё нужно пробиться сигнальной молекуле. Так что давайте вспомним её строение. Клеточная мембрана состоит из билипидного слоя, белков и углеводов. Билипидный слой состоит из двух слоев амфифильных липидов — у них есть гидрофобная и гидрофильная части. Из белков нас интересуют те, которые пронизывают мембрану насквозь — интегральные белки.
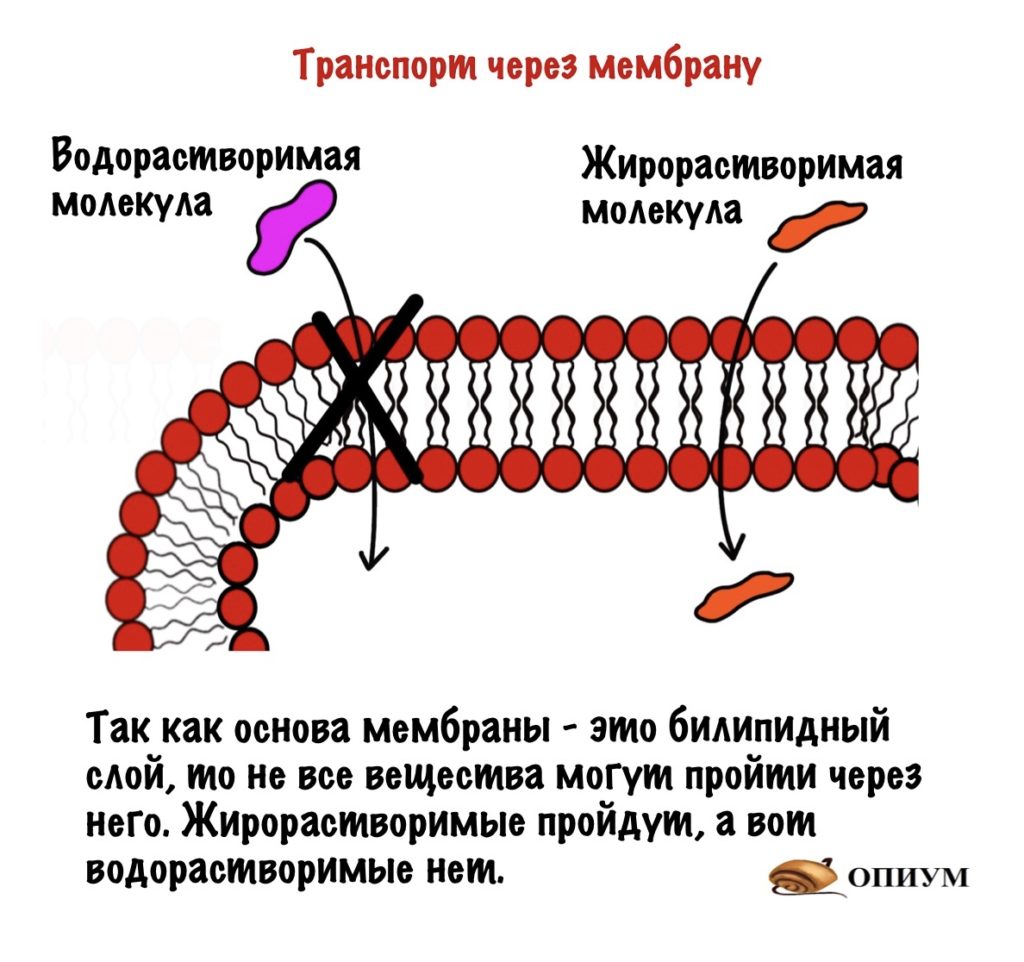
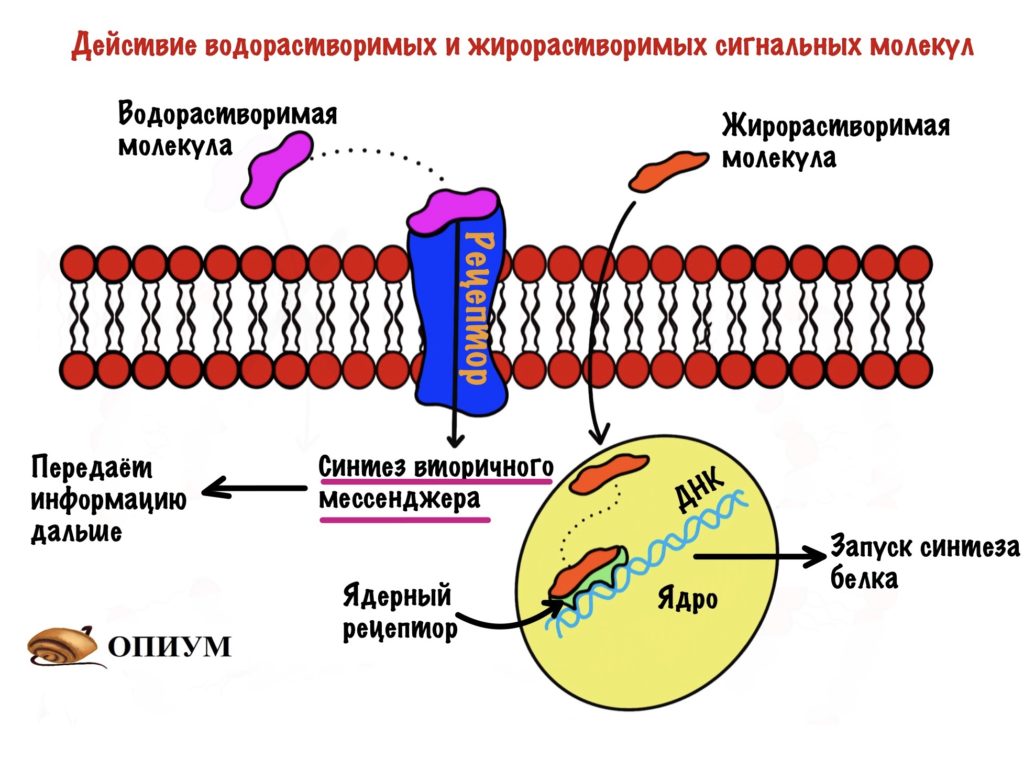
Так как мембрана состоит из билипидного слоя, то через неё могут проходить только жирорастворимые вещества. Водорастворимые пройти через неё не могут. Единственный вариант для них — связываться с белком.
Сигнальные молекулы могут быть жирорастворимыми и водорастворимыми. Жирорастворимые проходят через мембрану и связываются с внутриклеточным рецептором — чаще всего ядерным. Ядерные рецепторы находятся у ядра и отвечают за медленную регуляцию. Они запускают или блокируют синтез белка. Так что здесь всё просто.
Водорастворимые присоединяются к рецептору, связанному с G-белком или рецептором с ферментативной активностью. Такие рецепторы находятся в клеточной мембране — это интегральные белки. Но внутрь клетки сигнальные молекулы не попадают. Как же они тогда передают информацию? Они делают это с помощью вторичных мессенджеров. А первичный где? Первичным то и была сигнальная молекула. Общий принцип такой: присоединение первичного мессенджера приводит к синтезу вторичного мессенджера внутри клетки. Этот чувак передаёт информацию дальше. Похоже на эстафету.
Так что водорастворимым сигнальным молекулам нужен вторичный мессенджер, а жирорастворимым нет. Может быть вы подумали, что водорастворимые не действуют на ядро, но это не так. Они тоже могут запускать или блокировать синтез белка, но об этом ниже.
Рецепторы специфичны. На каждом рецепторе есть участок связывания, который располагается на внешней стороне мембраны. Он отвечает за специфичность рецептора. Это значит, что рецептор может присоединять только одну сигнальную молекулу. Так рецептор инсулина связывает только его, но не какой-нибудь фактор роста.
Теперь можно переходить к каждому в отдельности.
Рецепторы, связанные с G-белком
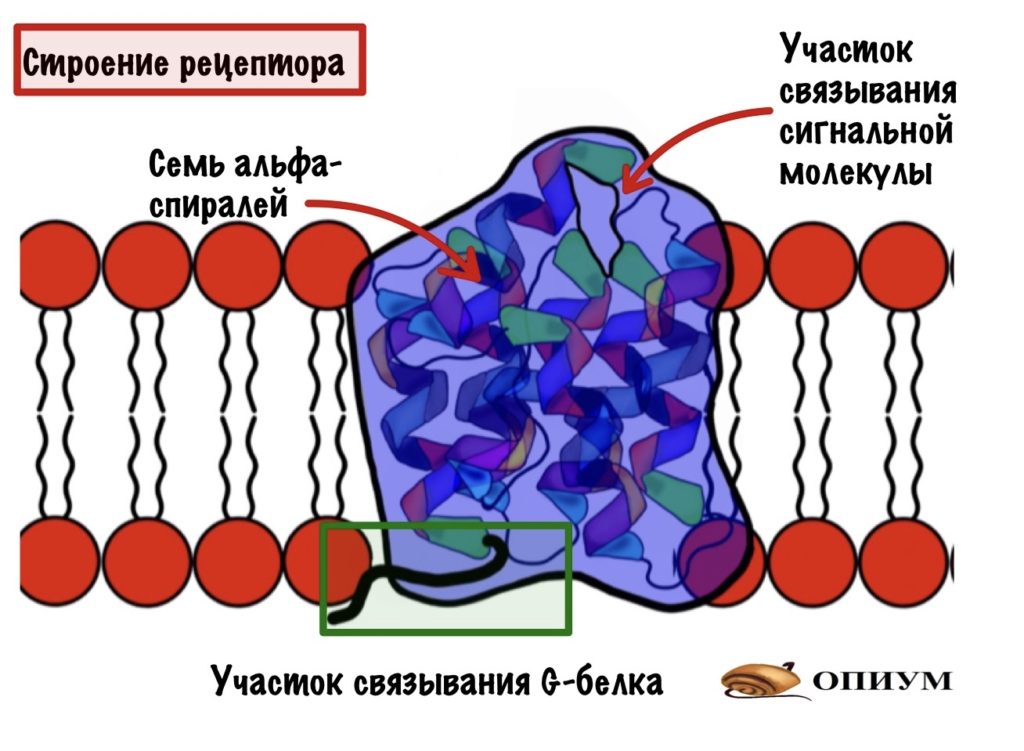
Рецептор — это интегральный белок, который состоит из семи альфа-спиралей. Альфа-спирали содержат гидрофобные радикалы, поэтому они могут пронизывать мембрану. У рецептора можно выделить две части: внеклеточную и внутриклеточную. На внеклеточной находится участок связывания для сигнальной молекулы. Или лиганда, всё-таки рецептор — это белок. А на внутриклеточной — участок связывания с G-белком.
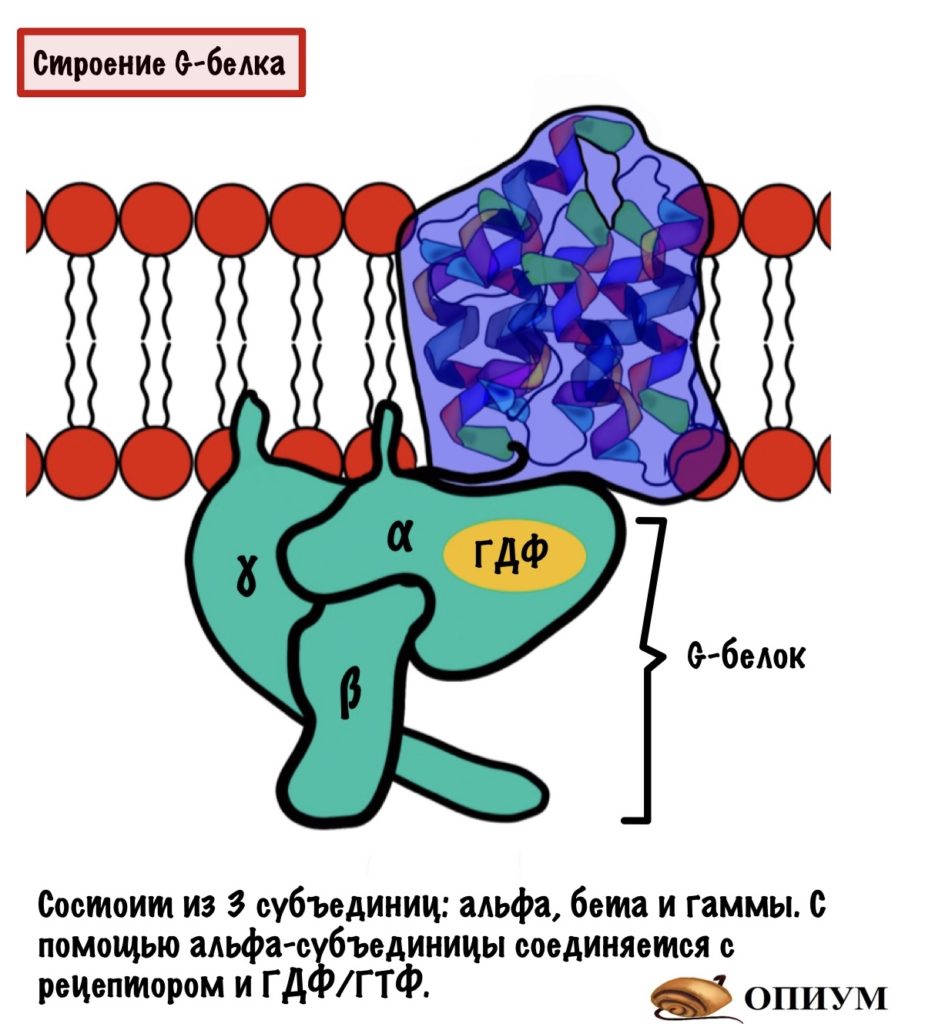
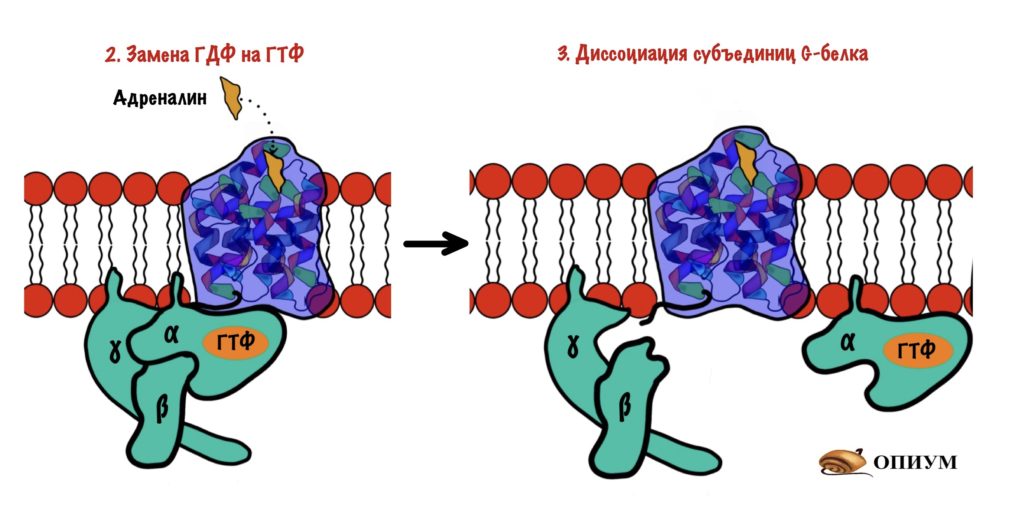
G-белок. Это белок, который имеет четвертичную структуру. Если у него четвертичная структура, то он состоит из нескольких субъединиц. Таких субъединиц три: альфа, бета и гамма. Почему белок называется G? Потому что он связывается с ГДФ или ГТФ (GDP или GTP) — гуанозиндисфосфат и гуанозинтрифосфат. За их связывание отвечает альфа-субъединица. Чуть ниже мы поговорим о том, почему он связан то с ГДФ, а то с ГТФ.
На рисунке видно, что у G-белка есть якори, с помощью которых он присоединяется к мембране.
Классический пример таких рецепторов — бета-2 адренорецепторы. Они связывают адреналин. Есть ещё альфа-1, альфа-2 и бета-1 адренорецепторы. Хоть на все эти рецепторы действует одно и тоже вещество, но клеточный ответ будет разным. Все зависит от типа рецептора. Мы разберём клеточный ответ на примере бета-2 и альфа-1 адренорецепторов. Интересный факт — на одной клетке может быть до четырёх тысяч бета-рецепторов, но ещё ведь есть и другие…
Давайте представим себя ситуацию, что я бегу от медведя. Ситуация странная, согласен. Да-да, я понимаю, что у меня ноль шансов — спасибо кеп. Но давайте подумаем, что нужно для того, чтобы убежать от медведя?
Мне нужна энергия и кислород, а точнее энергия и кислород нужны моим мышцам. В них есть запас того и другого в виде гликогена и миоглобина. Гликоген разрушается до глюкозы, которая перерабатывается в АТФ — главная батарейка для нашего организма. Максимум молекул АТФ можно получить только при наличии кислорода — за счёт аэробного гликолиза и работы дыхательной цепи. Но запас миоглобина не очень большой. Получается, что нужно пригнать кислород к мышцам — сердце будет качать кровь, как бешеное. Оно увеличит число своих сокращений и выброс крови из своих камер.
Для того, чтобы убежать от медведя нужны не только мышечные усилия, но и умственные. Где спрятаться? Что делать дальше? И ещё куча вопросов промелькнут в голове, а мозгу нужно выбрать лучшие варианты. Мозгу нужна глюкоза для его деятельности, а в крови её не слишком много. Здесь подключится печень — она начнёт разрушать свои запасы гликогена и отправлять их в кровь. Мозг получит дополнительный приток энергии.
Три органа пытаются спасти мою шкуру: печень, сердце и мышцы (не совсем орган, но да ладно). И работают они сообща! И знаете, что интересно? Всё это запустила всего одна сигнальная молекула — адреналин. В печени и мышцах она сделала это через запуск бета-2 адренорецепторов, а в сердце через альфа-1. Оба рецептора связаны с G-белком, но активируют разные системы. Бета-2 адренорецепторы активируют аденилатциклазную систему, а альфа-1 — инозитолфосфатную систему. Спокойно, сейчас разберёмся с этими системами. Просто запомните, что у них разные вторичные мессенджеры.
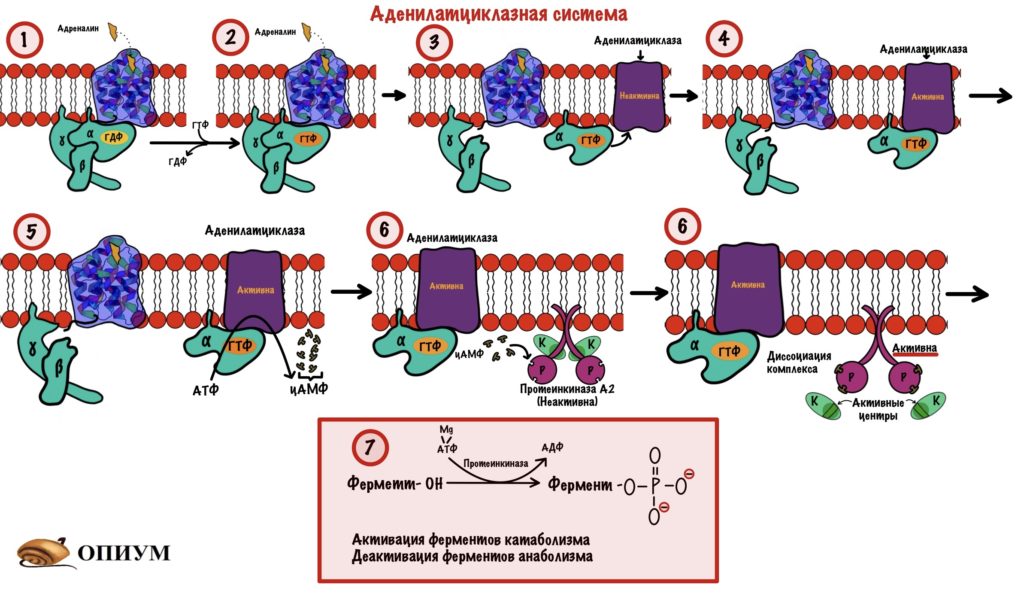
Аденилатциклазная система
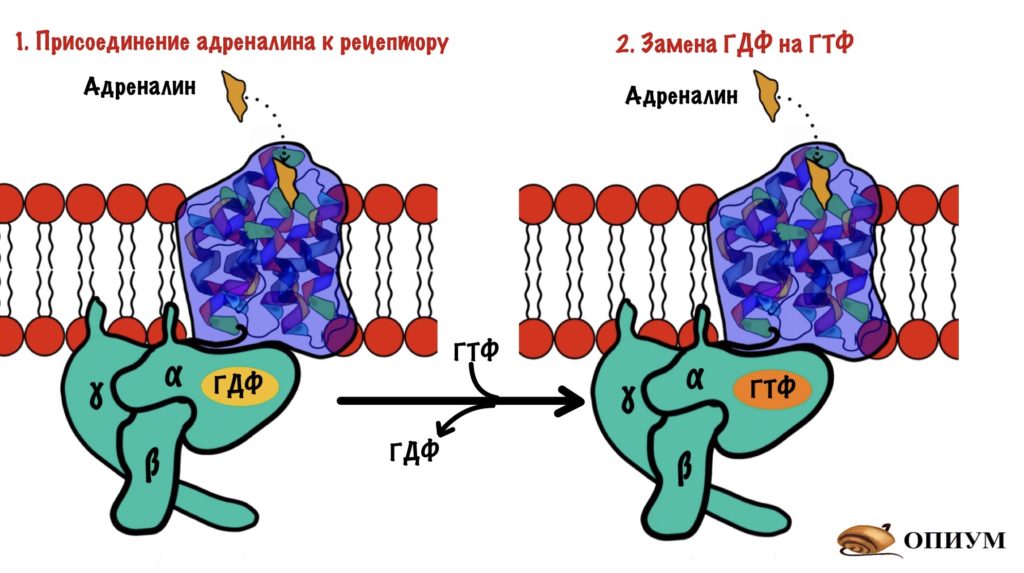
Адреналин связывается с внеклеточной частью рецептора. Это вызывает конформационные изменения в белковой молекуле рецептора. Помните, что конформационные изменения — это разрыв слабых связей с образованием других слабых связей? Из-за этого структура молекулы изменяется. Так вот, конформационные изменения приводят к тому, что альфа-субъединица G-белка теряет сродство к ГДФ. Она заменяется на ГТФ.
После замены ГДФ на ГТФ в белке снова происходят конформационные изменения. Альфа-субъединица решает, что она слишком засиделась со своими братанами — бета и гаммой. Происходит диссоциация комплекса G-белка. Альфа-субъединица связана с ГТФ. Бета и гамма до конца остаются вместе — вот это настоящие братья. Так G-белок становится активным.
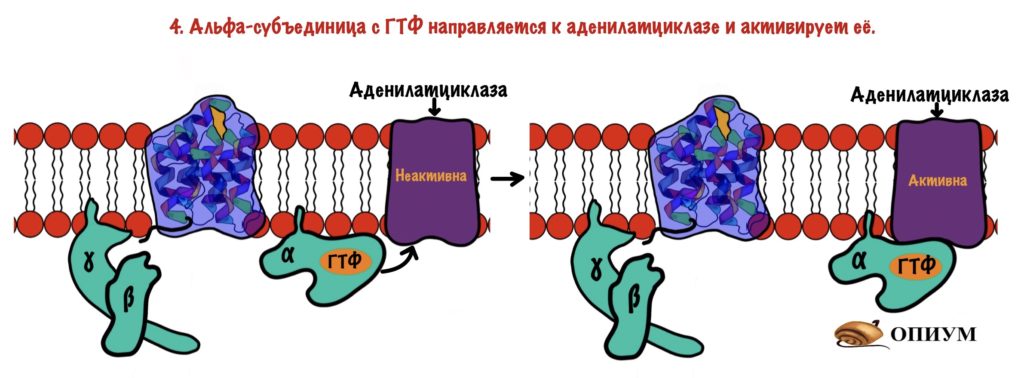
Дальше комплекс ГТФ с альфа-субъединицей направляете к аденилатциклазе и активирует её.
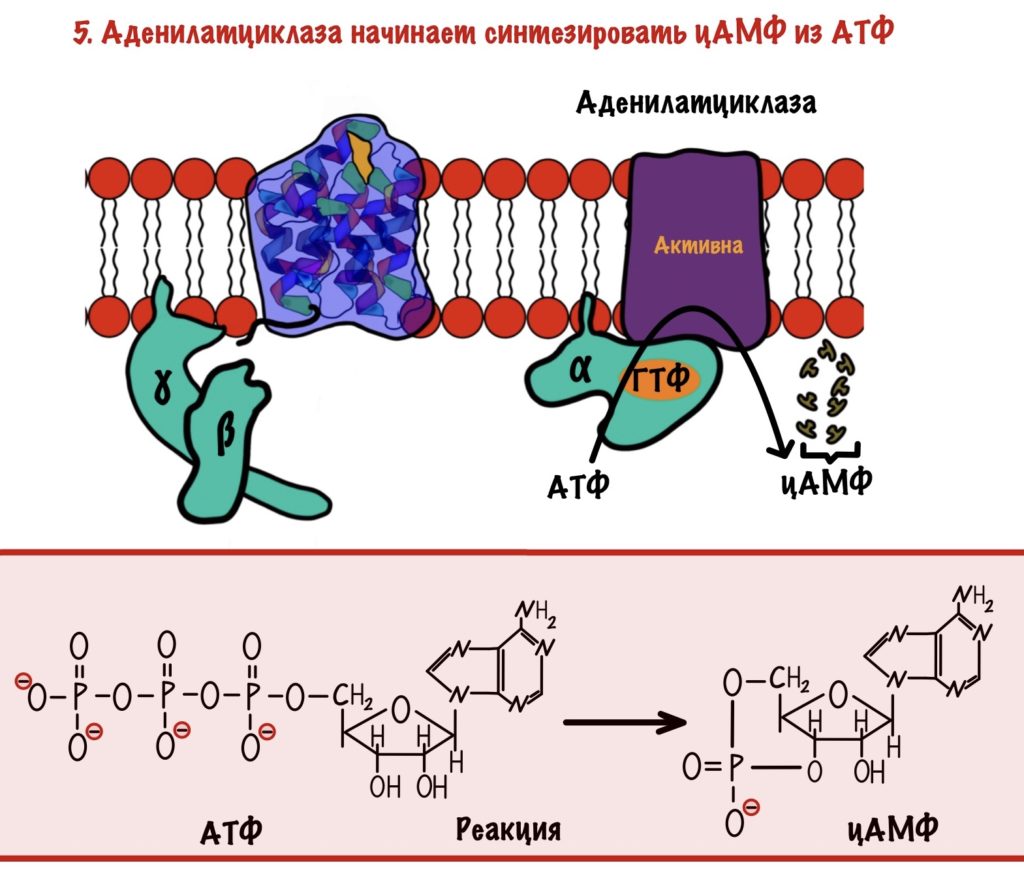
Аденилатциклаза — это интегральный белок, а точнее — фермент. Она занимается синтезом циклического аденозинмонофосфата (цАМФ) из АТФ. ЦАМФ — это вторичный мессенджер для аденилатциклазной системы.
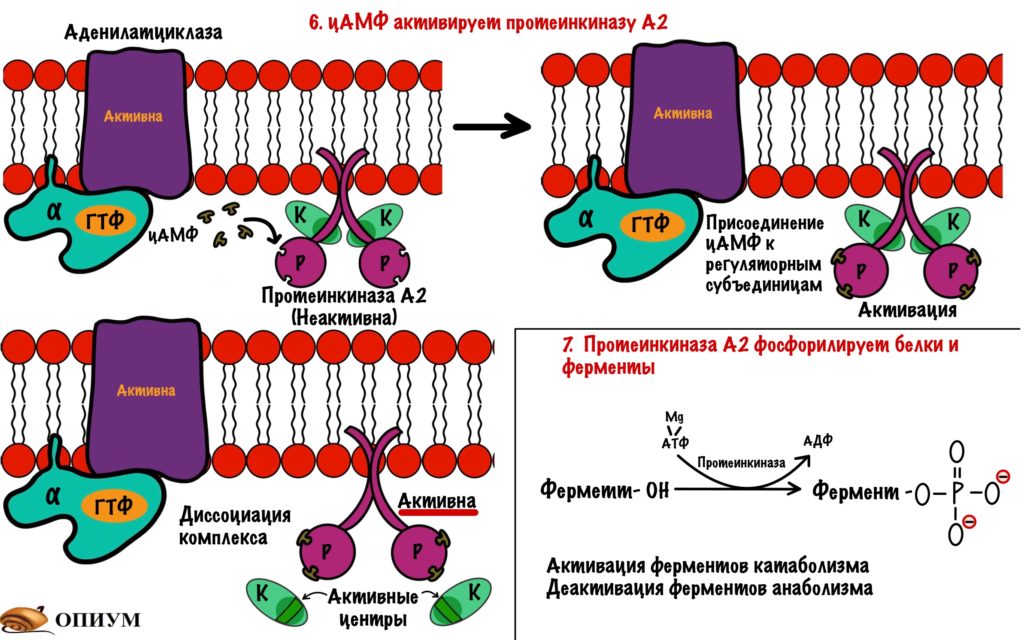
Аденилатциклаза становится активной только после присоединения к ней альфа-субъединицы с ГТФ. Далее цАМФ активирует протеинкиназу А2.
Протеинкиназа А2 — это тоже интегральный фермент. Она состоит из четырех субъединиц: двух каталитических и двух регуляторных. Комплекс из этих субъединиц — неактивен. При присоединении двух молекул цАМФ к каждой регуляторной субъединице происходит распад комплекса — его диссоциация. Каталитические субъединицы чувствуют свободу и начинают работать, какой-то парадокс. Они занимаются фосфорилированием белков и ферментов — переносят фосфатную группу от молекулы АТФ на фермент или белок. Фосфорилирование идёт по остаткам серина и треонина. Это приводит к активации ферментов, отвечающих за катаболизм. Начинается распад гликогена до глюкозы, а потом и до АТФ. В тоже время протеинкиназа А2 фосфорилирует ферменты анаболизма, которые становятся неактивными.
А теперь давайте повторим всё. Адреналин присоединяется к рецептору и вызывает конформационные изменения. Эти изменения ведут к конформационным изменениям в G-белке — он теряет сродство к ГДФ. ГТФ заменяет ГДФ в альфа-субъединице, что вызывает конформационные изменения в ней — она теряет сродство к бета и гамме. Комплекс G-белка диссоциирует: бета и гамма субъединицы остаются на месте, а альфа начинает путешествовать по мембране пока не наткнётся на аденилатциклазу. Альфа-субъединица с ГТФ присоединяется к аденилатциклазе, она становится активной. Её функция — продукция цАМФ из АТФ. цАМФ — это вторичный мессенджер для аденилатциклазной системы. ЦАМФ присоединяется к регуляторным субъединицам протеинкиназы А2. Протеинкиназа А2 становится активной, так как от неё диссоциируют каталитические субъединицы. Эти субъединицы занимаются фосфорилированием белков и ферментов: активируют ферменты катаболизма, но блокируют ферменты анаболизма.
Почему так сложно?
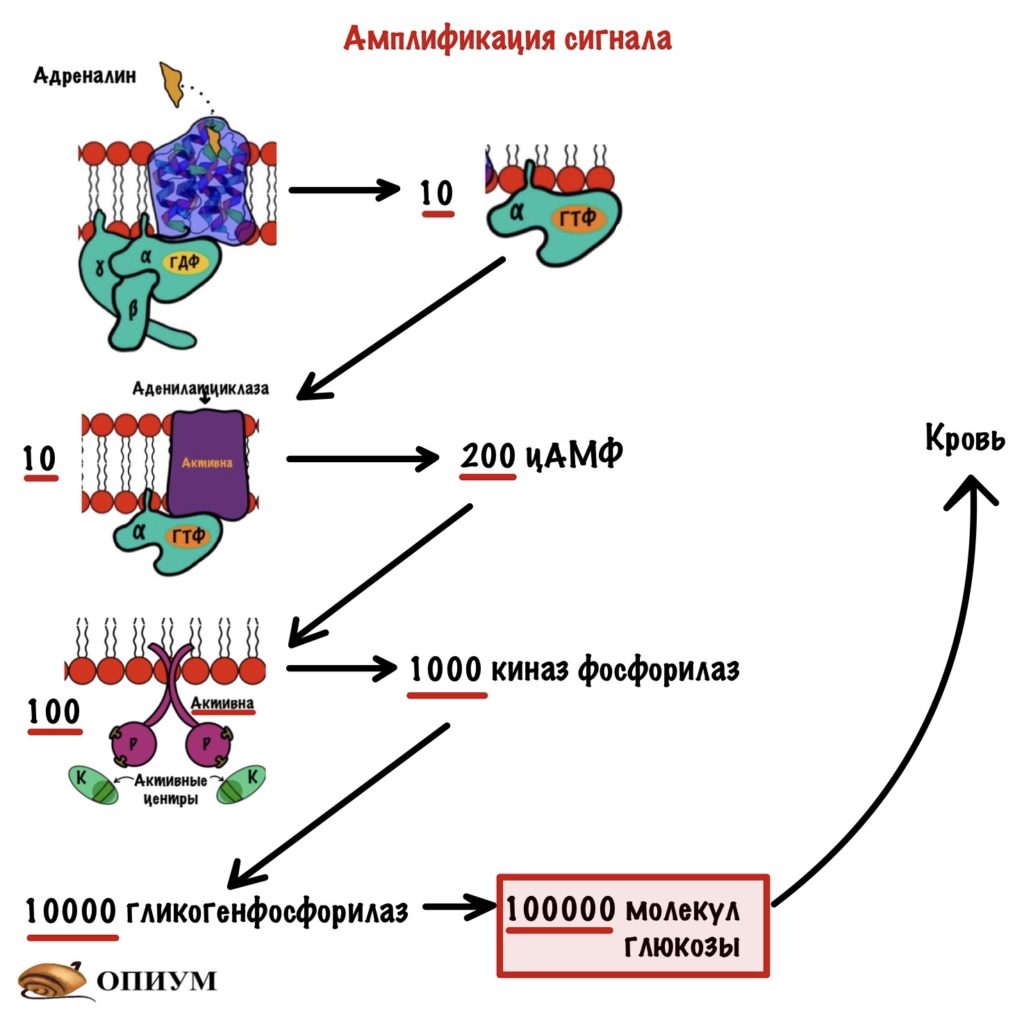
Ну и зачем столько этапов? Почему так сложно? Не проще было адреналину сразу же активировать фермент? Не проще. Давайте прикинем себе ситуацию. Адреналин выделился из мозгового вещества надпочечников. Его там определённое количество, скажем — миллиард молекул. Я не считал если что, так что цифра из головы. Каждая молекула активирует один фермент. Сколько всего клеток? Много. А сколько в них ферментов? Ещё больше. Если адреналин будет активировать только один фермент, то нашего миллиарда хватит всего на сотню клеток, а может и меньше. Какая-то не очень хорошая история. Всё происходит не так.
Адреналин присоединяется к рецептору и запускает не один G-белок, а сразу несколько — штук десять. Эти десять G-белков активируют десять молекул аденилатциклазы. Но они синтезируют не десять молекул цАМФ, а двести. Эти двести молекул активируют сто протеинкиназ А2 — на каждую регуляторную субъединицу нужно по две молекулы цАМФ. Протеинкиназа А2 фосфорилирует тысячу молекул киназы фосфорилазы B. Тысяча молекул киназы фосфорилазы активирует десять тысяч ферментов — гликогенфосфорилаз. Она занимается отщеплением молекулы глюкозы от гликогена. В результате мы получаем сто тысяч молекул глюкозы. И всё это запустила только одна молекула адреналина, которая подействовала только на один рецептор!
Такая сложность и столько этапов нужно для усиления сигнала внутри клетки. Этот процесс называется амплификация. Одна молекула адреналина, которая подействовала на печень, дала моему организму сто тысяч молекул глюкозы. Она будет использована мозгом и другими клетками.
В мышцах будет такое же усиление сигнала, но все сто тысяч молекул глюкозы пойдут для получения энергии — в гликолиз. И это всего один рецептор! А на клетке их намного больше, да и в крови летает не одна молекула адреналина.

Как сигнальная молекула перестаёт действовать на клетку
Теперь представим, что я убежал медведя. Это настоящее чудо, не зря я смотрел Тачки столько раз. Проходит минут десять и я успокаиваюсь — опасность миновала. Но как отрубить систему, которая так удачно спасла мне жизнь? Было бы не очень, если она работала без остановки. Так мой организм быстро бы истощал и помер. Есть несколько способов по остановке этого механизма.
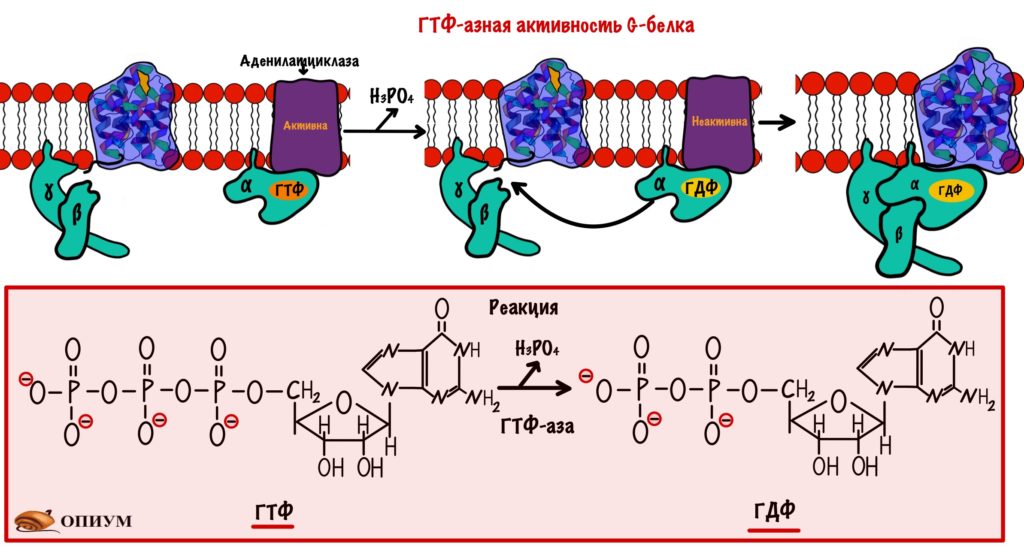
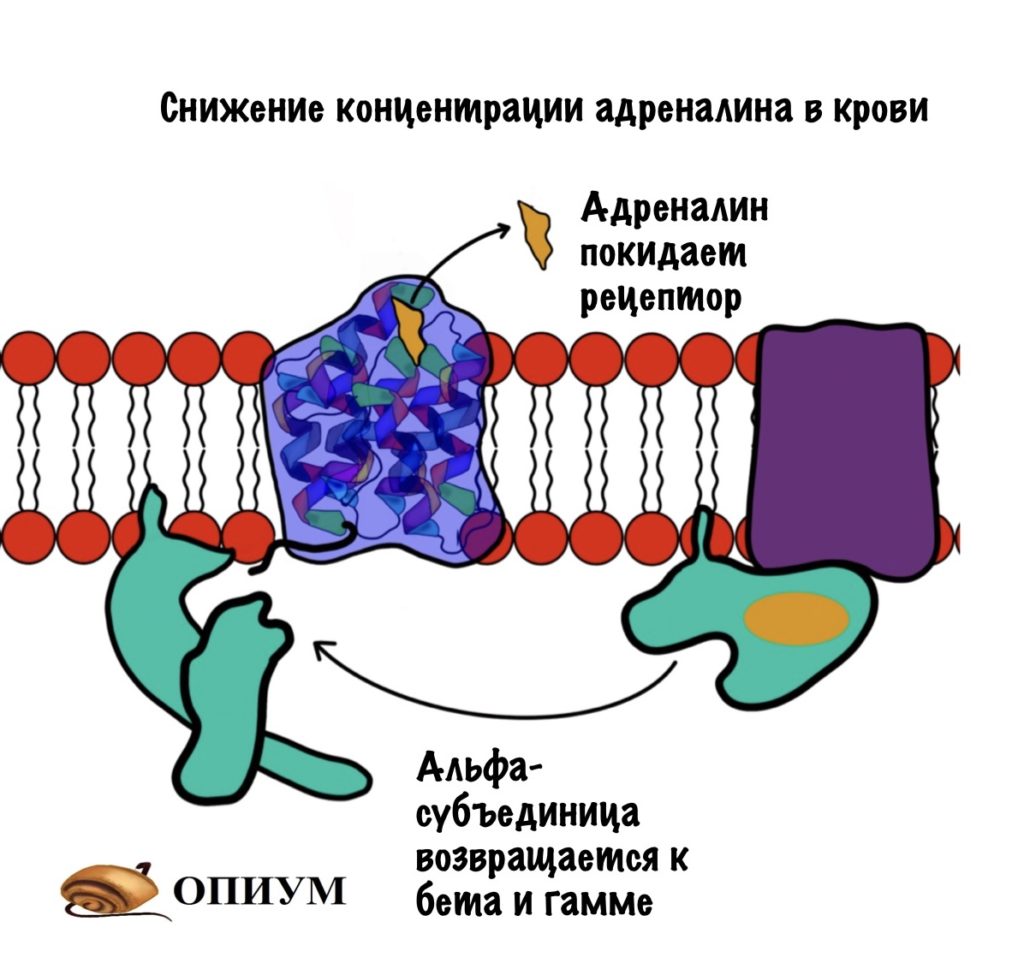
Дефосфорилирование G-белка. Альфа-субъединица G-белка не только отвечает за связывания ГТФ и ГДФ, у неё есть ещё одна особенность. Она может превращать ГТФ в ГДФ — путём гидролиза. Поэтому альфа-субъединицу можно назвать ГТФ-азой. После образования ГДФ из ГТФ у альфа-субъединицы снижается сродство к аденилатциклазе. Но увеличивается к бета и гамме субъединицам. Аденилатциклаза перестаёт синтезировать цАМФ, а альфа-субъединица объединяется с бета и гаммой субъединицами. Уменьшение цАМФ приводит к инактивации протеинкиназы А2. Она перестаёт фосфорилировать другие белки и ферменты. Получается, что альфа-субъединица выключает сама себя.
Если G-белок возвращается в своё исходное состояние, но к рецептору все ещё присоединён адреналин, то цикл повторяется. Снова ГДФ заменяется на ГТФ, а дальше ты уже всё знаешь.
На самом деле у альфа-субъединицы очень маленькая ГТФ-азная активность, но есть белки которые увеличивают её. Они называются ГТФазные активирующие белки. Ну это так — для общего развития.
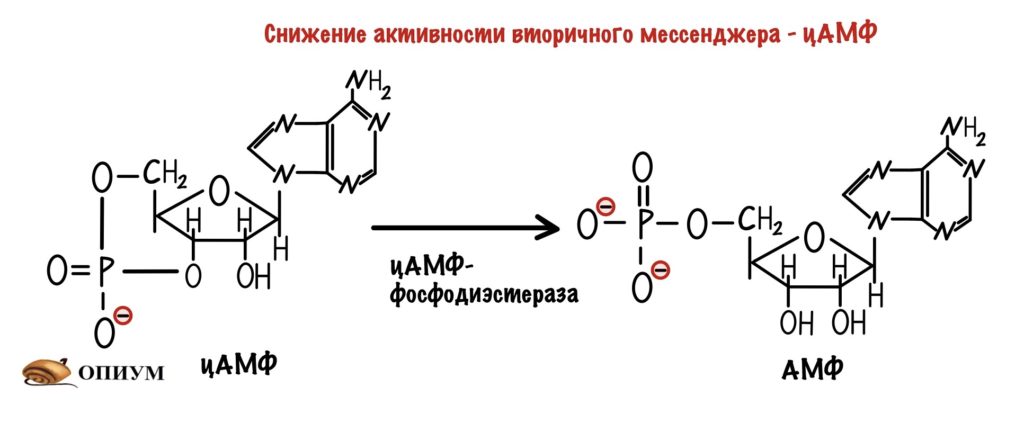
ЦАМФ-фосфодиэстераза. Этот фермент почти всегда работает в клетке, он занимается превращением цАМФ в 5-АМФ. Получается, что фосфодиэстераза уменьшает количество вторичного мессенджера, регулируя передачу сигнала. 5-АМФ обладает намного меньшей активностью, чем цАМФ. Но она всё таки есть.
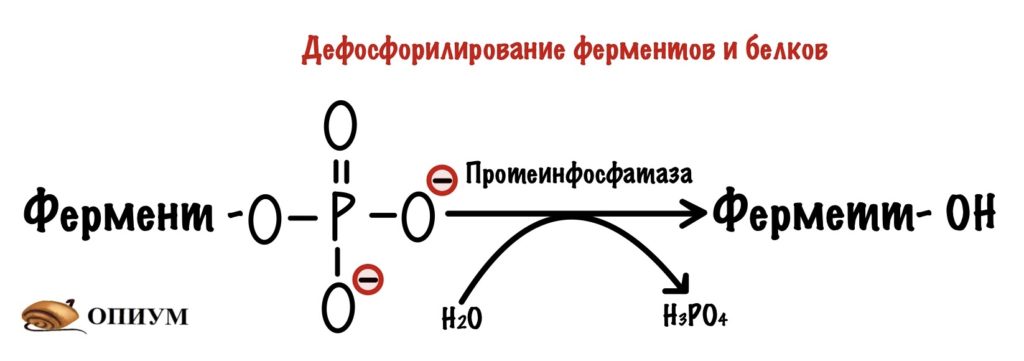
Протеинфосфатазы. Эти ферменты занимаются дефосфорилированием белков и ферментов — переводят их в неактивную или активную форму. Чаще всего ферменты анаболизма активны в дефосфорилированной форме. А вот ферменты катаболизма, наоборот, неактивны в дефосфорилированной форме.
Все эти механизмы не связаны с рецептором адреналина, который пронизывает мембрану. Но можно повлиять и на него. Смотрите, что происходит в норме: после стрессовой ситуации концентрации адреналина уменьшается — его становится меньше в крови. Он отсоединяется от рецептора и всё — система выключается. G-белок вернётся к своим братанам после того, как превратит ГТФ в ГДФ. А что будет с аденилатциклазой и протеинкиназой вам понятно.
Но иногда адреналина всё время много! Допустим, что у человека опухоль надпочечника, которая всё синтезирует и синтезирует адреналин. Или человек живёт в хроническом стрессе. Обе ситуации очень опасны, но у организма есть небольшая подушка, которая уменьшает вред от этих проблем.
Десенсибилизация бета-адренорецепторов
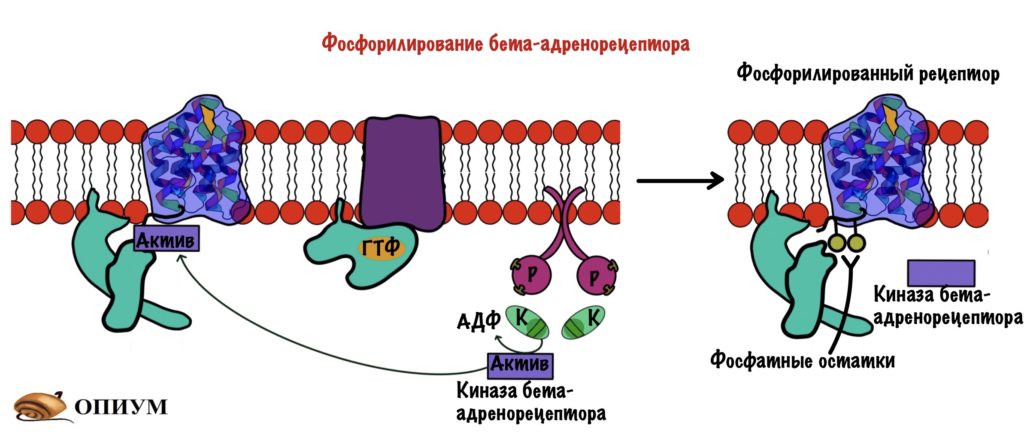
Клетку атакует адреналин — она всё время синтезирует цАМФ, которая активирует протеинкиназу А2. Протеинкиназа активирует другие ферменты, а среди них есть киназа бета-адренорецептора. На внутриклеточной стороне мембраны у рецептора адреналина есть остатки: серина, треонина или тирозина. Киназа бета-адренорецептора фосфорилирует эти остатки.
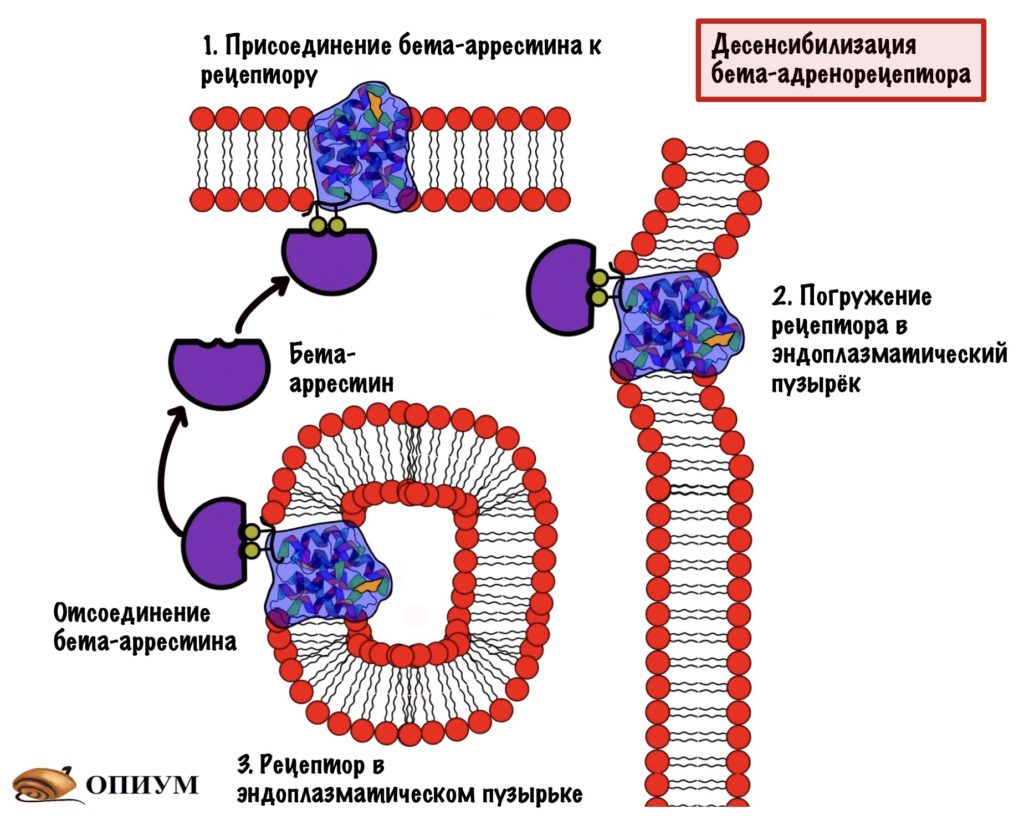
После этого к этим остаткам присоединяется белок — бета-аррестин. Образуется комплекс рецептора и бета-аррестина. Этот комплекс не даёт присоединиться G-белку на своё место — происходит десенсибилизация рецептора. Этот комплекс погружается в клетку с помощью эндоцитоза. Какое-то время рецептор находится в эндоцитозном пузырьке, где происходит его дефосфорилирование и разрушение адреналина, который связан с ним. После этого рецептор возвращается в мембрану и продолжает выполнять свои функции.
Вот такая подушка безопасности для того, чтобы спасти клетку от чрезмерных стимулов.
Есть и другой вариант отключения. Остатки серина и треонина могут быть фосфорилированы и другими протеинкиназами. Например, протеинкиназой А2. После этого к рецептору не может присоединиться G-белок, так что бета-аррестин не обязателен — достаточно фосфорилировать рецептор.
Вот какие сигнальные молекулы используют цАМФ, как вторичный мессенджер — через запуск G-белков.
Но мы ещё не разобрали то, как адреналин действует на сердце. Сейчас этим займёмся. Здесь будет другой тип адренорецептора — альфа-1, а ещё другие вторичные мессенджеры.
Инозитолфосфатная система
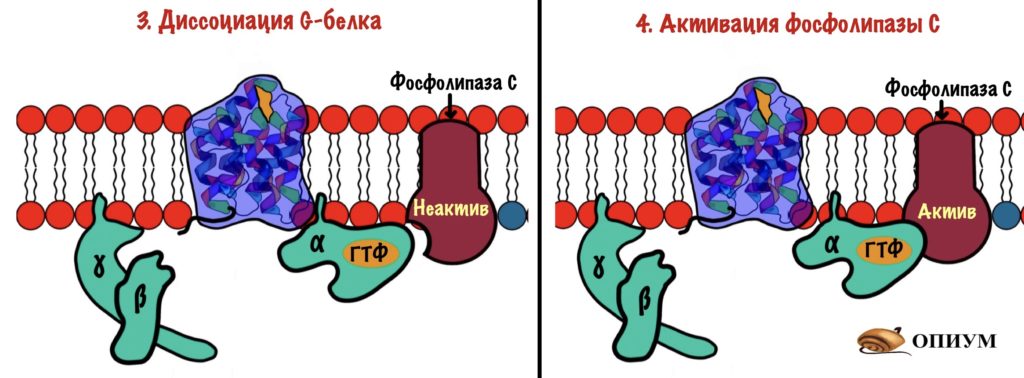
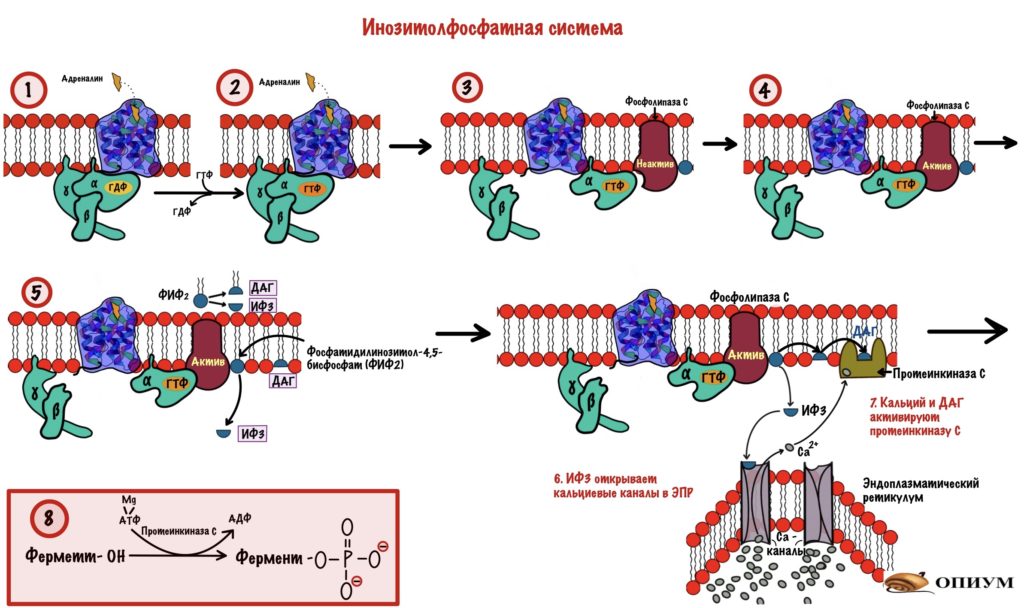
Похожа на прошлую систему — действует через G-белок. Только вторичные мессенджеры будут другими. Начальные этапы схожи. Адреналин присоединяется к рецептору: вызывает конформационные изменения в нём, что приводит к смене ГДФ на ГТФ в альфа-субъединице G-белка. Происходит диссоциация комплекса на альфа-субъединицу с ГТФ и бету с гаммой. Тут начинаются отличия.
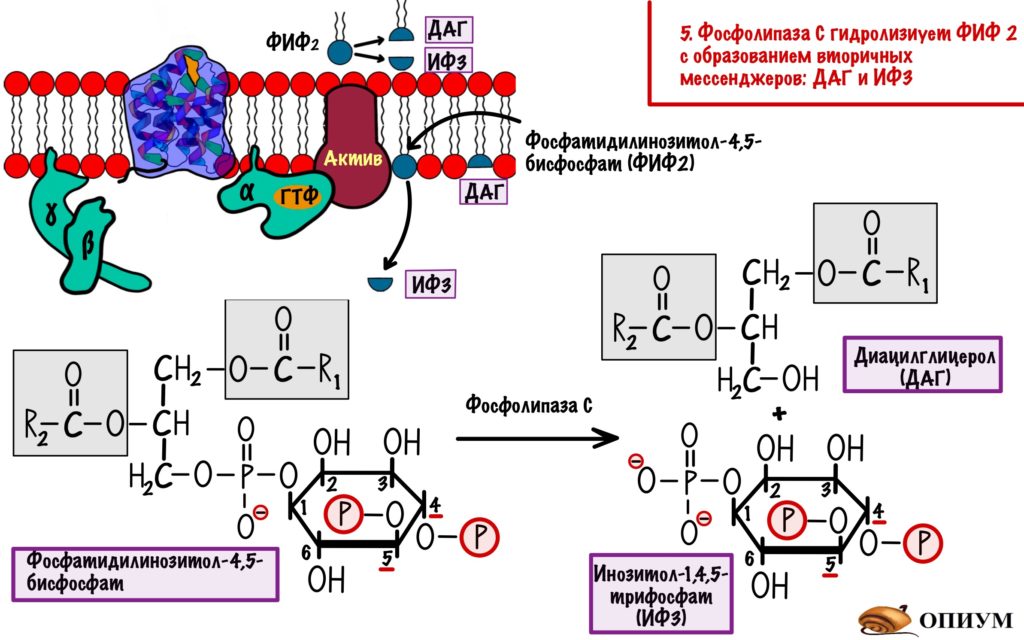
Альфа-субъединица активирует фосфолипазу C — интегральный белок. Этот фермент гидролизирует фосфатидилинозитол-4,5-бисфосфат (ФИФ2).
Фосфатидилинозитол-бисфосфат — это липид, который находится в мембране и обладает амфифильностью. В результате его гидролиза образуется диацилглицерол (ДАГ) и инозитол-1,4,5-трифосфат (ИФ3).
ДАГ — это неполярная молекула, она не сможет путешествовать в цитоплазме без переносчика. Поэтому ДАГ передвигается в пределах мембраны. Но вот ИФ3 — это полярная молекула, которая может гулять в цитоплазме сколько хочет. ИФ3 и ДАГ — вторичные мессенджеры для инозитолфосфатного пути. Целых два! А я даже скажу, что есть и третий.
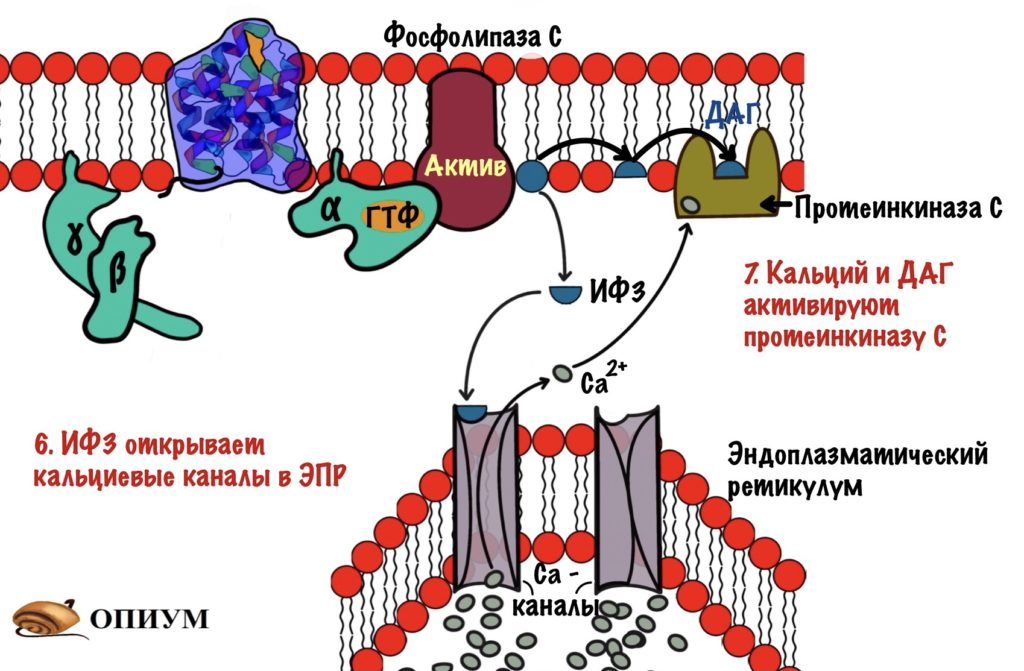
ИФ3 выходит в цитоплазму и направляется к эндоплазматическому ретикулуму (ЭПР). В ЭПР находится депо кальция. Мы поговорим о об этом депо — зачем и для чего оно нужно, но чуть позже. А пока нужно запомнить, что в ЭПР находится кальций и он — третий вторичный посредник для инозитолфосфатного пути. И ещё одно — кальция очень мало в цитоплазме, но много в ЭПР.
ИФ3 открывает кальциевые каналы — кальций вылетает в цитоплазму, так как его концентрация в ней очень мала (помним же про градиент концентрации?). Он направляется к протеинкиназе C. Угадаете чем она занимается? Ага, фосфорилированием других белков и ферментов. Протеинкиназа C -это мембранный фермент, что-то у нас сегодня все сидят на мембране. Для его активации нужен не только кальций, но и диацилглицерол (ДАГ). Но так как фермент сидит в мембране, то диацилглицеролу не трудно добраться до него. В активном центре протеинкиназы C находится домен, который мешает ей работать. При присоединении ДАГ и кальция этот домен перемещается из активного центра — протеинкиназа С начинает фосфорилировать белки цитоскелета, ферменты и ядерные белки. Этим она переводит их в активное состояние.
Держите общую схему инозитолфосфатной системы для повторения.
Немного про кальций
Кальций не только занимается активацией протеинкиназы С, у него есть и другие функции. Но сначала давайте разберёмся с тем, почему кальция так мало внутри клетки. И почему он весь сидит внутри эндоплазматического ретикулума.
Ответ простой — избыток кальция опасен. У кальция положительный заряд 2+, поэтому он может связываться с белками. Проблема в том, что такое связывание убирает заряд в белках. Они теряют свою растворимость в цитоплазме, соединяются друг с другом и выпадают в осадок. Такое связывание называется преципитацией. Если белок выпал в осадок, то он потерял свою функцию.
Вот такой опасный парниша этот кальций. Раз он опасен, но при этом является вторичным мессенджером, то для него нужна строгая система контроля. Такой контроль осуществляет белки, связывающие кальций. Типо тропонина С и кальмодулина.
Кальмодулин это небольшой белок — всего 148 аминокислотных остатка. Он похож на руку. Эта рука может связать целых четыре иона кальция. Комплекс кальция и кальмодулина активирует другие белки и ферменты. Например, кальций/кальмодулин-зависимую протеинкиназу. Но активация здесь не через фосфорилирование, а он просто регуляторная субъединица. То есть фермент становится активным при присоединении комплекса кальция с кальмодулином.
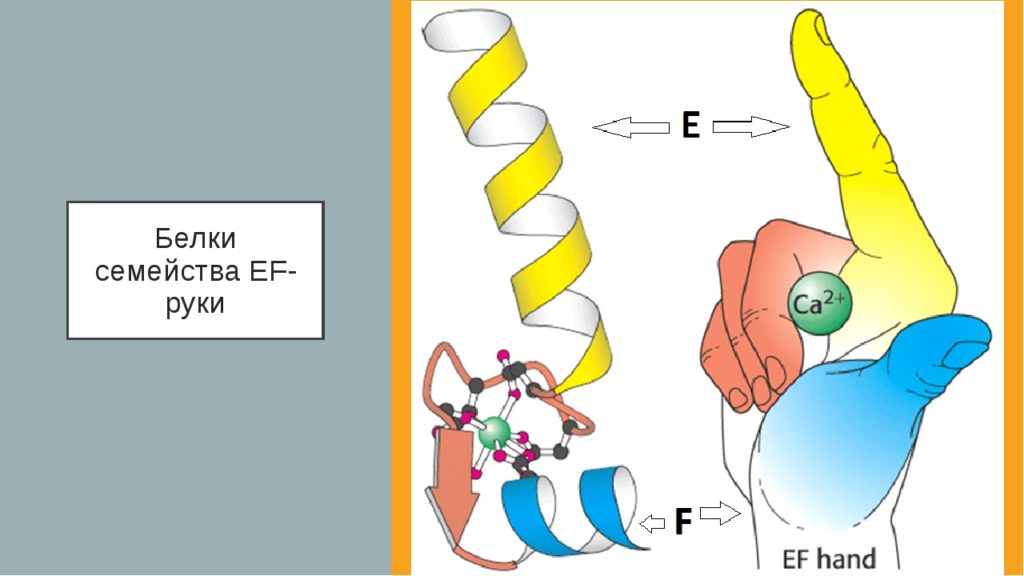

В мышечной ткани кальций связывается с тропонином С — это вызывает мышечное сокращение. По такому механизму увеличилась частота сердечных сокращений и выброс крови при моем бегстве от медведя.
Кальмодулин с кальцием активирует киназу фосфорилазы b — мы уже с ней встречались в аденилатциклазной системе. Так что инозитолфосфатный путь тоже увеличит распад гликогена. Ещё кальций может запускать аденилатциклазу и фосфодиэстеразу. Видите? Между двумя механизмами — аденилатциклазным и инозитолфосфатным есть связь.
Кальций ответственен за экзоцитоз, эндоцитоз и сокращения мышц. Так что функций очень много, даже слишком. Я написал это для того, чтобы вы понимали сколько всего в клетке может делать «какой-то» ион. Получается, что кальций — герой.
Как выключить?
Не забываем, что инозитолфосфатная система связана с G-белком. Значит, что она может отключаться с помощью ГТФ-азной активности альфа-субъединицы. Активация системы приводит к фосфорилированию белков и ферментов. Может просто дефосфорилируем их? А давайте, здесь нам снова помогут протеинфосфатазы. Ну и понятное дело, что при снижении концентрации гормона в крови система отключится.
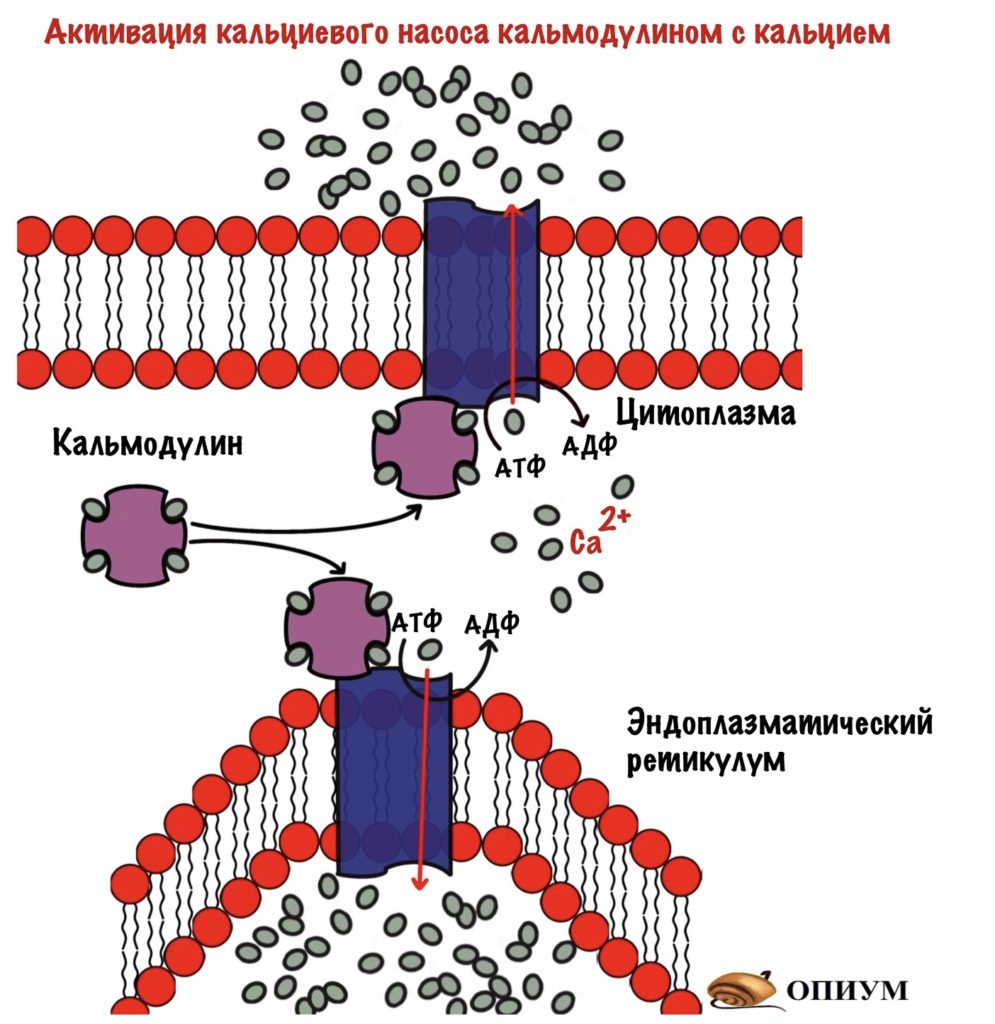
Ещё можно снизить концентрацию вторичного мессенджера — нужно убрать кальций из цитоплазмы. Это можно сделать двумя способами: выкачать его из клетки, либо закачать его в эндоплазматический ретикулум. Оба эти варианта активируются комплексом кальмодулина с кальцием. При присоединении комплекса кальция с кальмодулином к Ca2+-АТФазе (кальциевый насос) — он активируется. Начинает выкачивать кальций из цитоплазмы. Правда на это нужна энергия, потому что кальция в ЭПР и так много — транспорт идёт против градиента концентрации. Придётся потратить молекулы АТФ…
Организм не любит ничего терять, поэтому чаще кальций закачивается обратно в ЭПР.
Локальность и быстрота ответа
Вы представляете себе, что одна сигнальная молекула активирует рецептор с G-белком, а потом выделяется куча кальция. Но это не так. На самом деле это быстрый и локальный ответ. В месте прикрепления сигнальной молекулы возрастает концентрация кальция, но только в этом месте! Этот кальций участвует в регуляции, а потом тут же выкачивается из клетки. Получается, что регуляция кальция временная и локальная.
Честно говоря, аденилатциклазная система действует точно также. Сигнальные молекулы не будоражат всю клетку разом. Они вызывают локальный ответ, который ограничен по времени. Понятное дело, что если на клетке много рецепторов к сигнальной молекуле, а ее концентрация большая, то клетка ответит дай бог каждому.
Но как так получается? Мы видели, что все главные ферменты, которые активируются сигнальной молекулой, сидят на мембране. Протеинкиназы, фосфолипазы, аденилатциклазы — все эти белки находятся на мембране. Некоторые из них не только сидят на мембране, но и образуют единые комплексы с помощью мультивалентных белков. Эти белки держат ферменты рядом друг с другом. Часто вместе сидят протеинкиназа и протеинфосфатаза. После фосфорилирования фермента он выполняет свои функции, а потом отключается фосфатазой. Так обеспечивается локальность ответа и его быстрота. Чем больше концентрация сигнальной молекулы, тем дольше действует ответ в клетке. Чем больше концентрация сигнальной молекулы, тем большая область клетки будет задействована — меньше локальность.
Вот сигнальные молекулы, которые действуют через инозитолфосфатную систему.
Какие еще функции у G-белков?
Мы разобрали примеры, в котором G-белки активируют ферменты — аденилатциклазу и фосфолипазу С. Такие белки — активирующие. Но иногда G-белки могут быть ингибирующими. Давайте разберём на примере аденилатциклазы.
Сигнальная молекула действует на рецептор. Происходят его конформационные изменения, в G-белке ГДФ меняется на ГТФ. Комплекс субъединиц распадается, и альфа-субъединица с ГТФ направляется к аденилатциклазе. Они соединяются, но аденилатциклаза неактивна. Делаем вывод, что не все G-белки активируют ферменты — некоторые ингибируют.
G — белки ответственны за ощущения запахов и вкуса. Да и даже за зрение! Там немного другие механизмы, но всё таки. Как-нибудь мы о них поговорим.
Рецепторы с ферментативной активностью
У этих рецепторов тоже есть участок связывания на внешней стороне мембраны. Но на внутренней стороне находятся участки, которые обладают ферментативной активностью. Это могут быть тирозинкиназы — переносят фосфатные группы на остатки тирозина. Либо гуанилатциклазы — синтезируют цГМФ из ГТФ. Давайте начнём с тирозинкиназ, а разбираться будем на примере инсулина.
Рецепторы с тирозинкиназной активностью
Представьте, что вы съели шоколадный торт. Концентрация глюкозы в крови увеличилась. В какой-то момент кровь попадёт в клетки островков Лангерганса, которые находятся в поджелудочной железе. А именно в бета-клетки — они занимаются синтезом инсулина. Поджелудочная решит, что так дело не пойдет — глюкозы в крови слишком много, а это опасно. Нужно закинуть её в клетки и запасти. Но для этого нужны переносчики глюкозы через мембрану (ГЛЮТы), которых в ней пока что нет. И вот поджелудочная выкидывает в кровь инсулин, и концентрация глюкозы вдруг снижается. Как же это получилось?
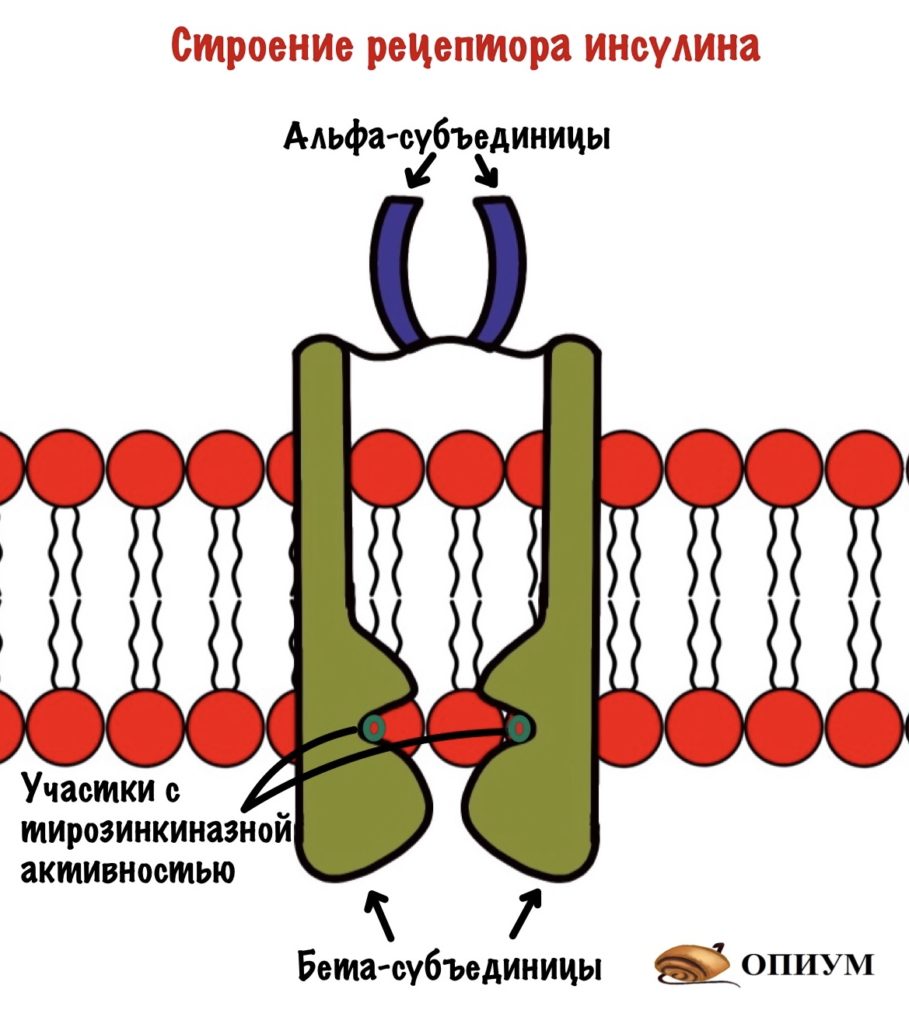
Рецептор инсулина состоит из четырёх субъединиц: двух альфа и двух бета. Альфа находятся на внешней стороне мембраны и ответственны за связывание инсулина. Бета субъединицы пронизывают биологическую мембрану. А на внутренней стороне мембраны у них есть участки, которые обладают тирозинкиназной активностью. Участки, обладающие тирозинкиназной активностью находятся на расстоянии друг от друга.
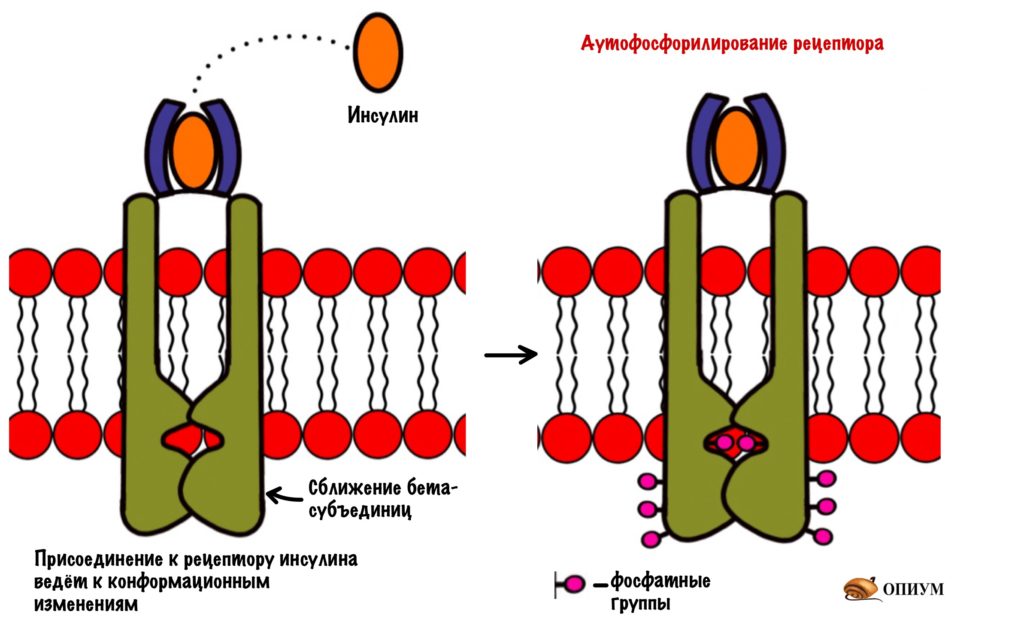
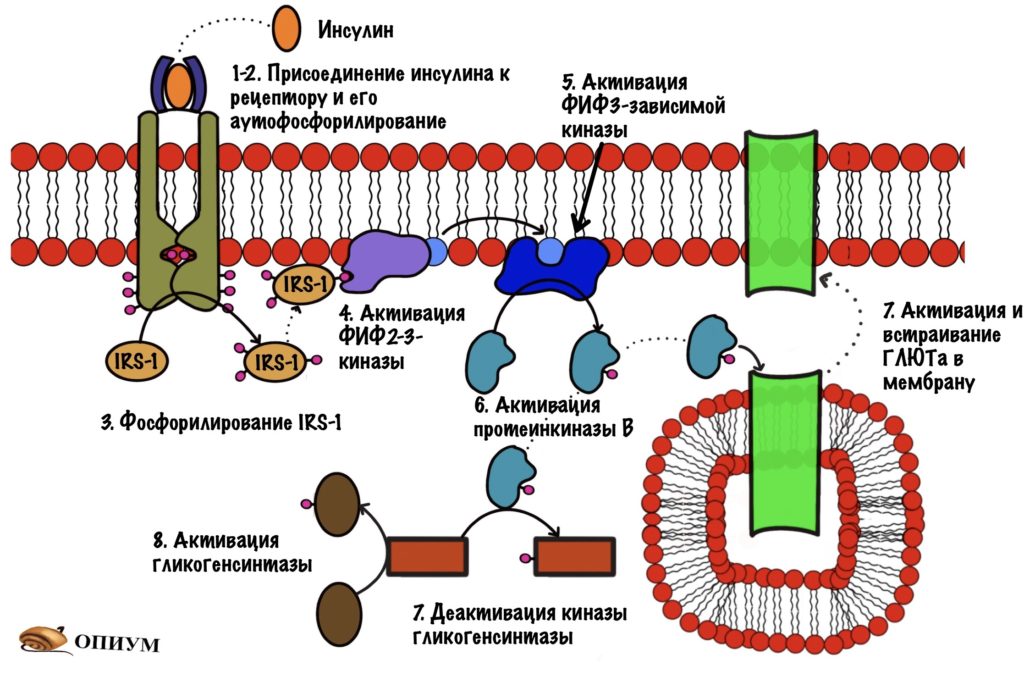
При присоединении инсулина к рецептору в нём происходят конформационные изменения. Участки с тирозинкиназной активностью сближаются. На этих участках есть остатки тирозина. И вот один участок активирует другой, фосфорилируя его. Такое вот аутофосфорилирование. После этого участки могут фосфорилировать другие белки и ферменты. Можно сказать, что рецептор инсулина — это продвинутая протеинкиназа. Ей даже G-белок не нужен. Только преподам такое не говорите.
И тут есть два пути, по которому может дальше пойти фосфорилирование. Первый путь попроще — он связан с активацией синтеза гликогена и встраиванием в мембрану белков переносчиков (ГЛЮТов). А вот второй — связан с действием инсулина на ядро, он посложнее. Давайте начнём с того, что попроще — снизим уровень глюкозы и активируем синтез гликогена.
Активация белков переносчиков и синтеза гликогена
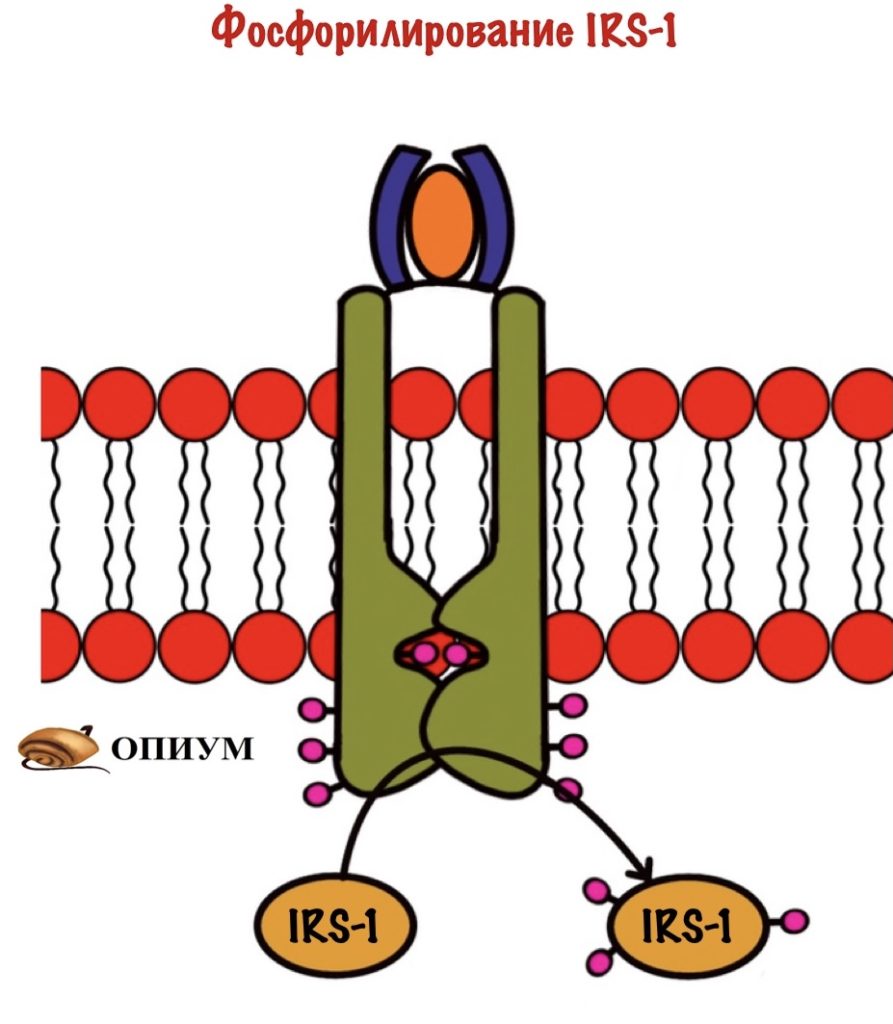
Мы активировали рецептор, когда он соединился с инсулином. Активация произошла с помощью аутофосфорилирования. Дальше рецептор фосфорилирует белок IRS-1. А если по-русски, то первый субстрат для рецептора инсулина ( или субстрат инсулинового рецептора). Фосфорилирование идёт по остаткам тирозина, которых на IRS-1 несколько. IRS-1 не фосфорилирует другие белки, он просто присоединяют их к себе. После присоединения они начинают выполнять свои функции.
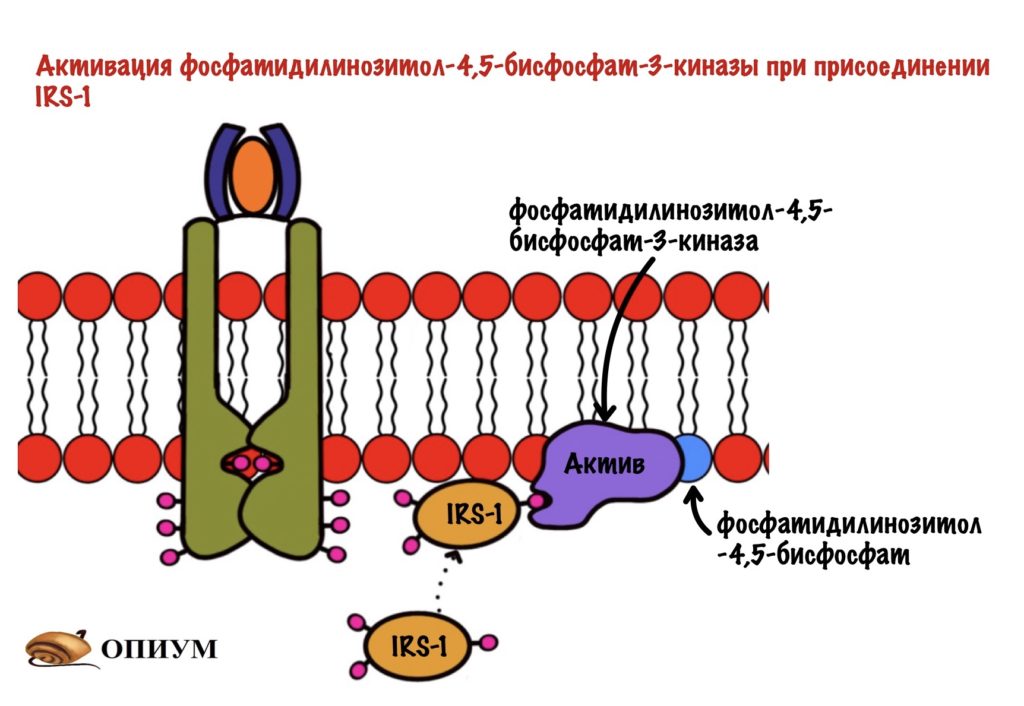
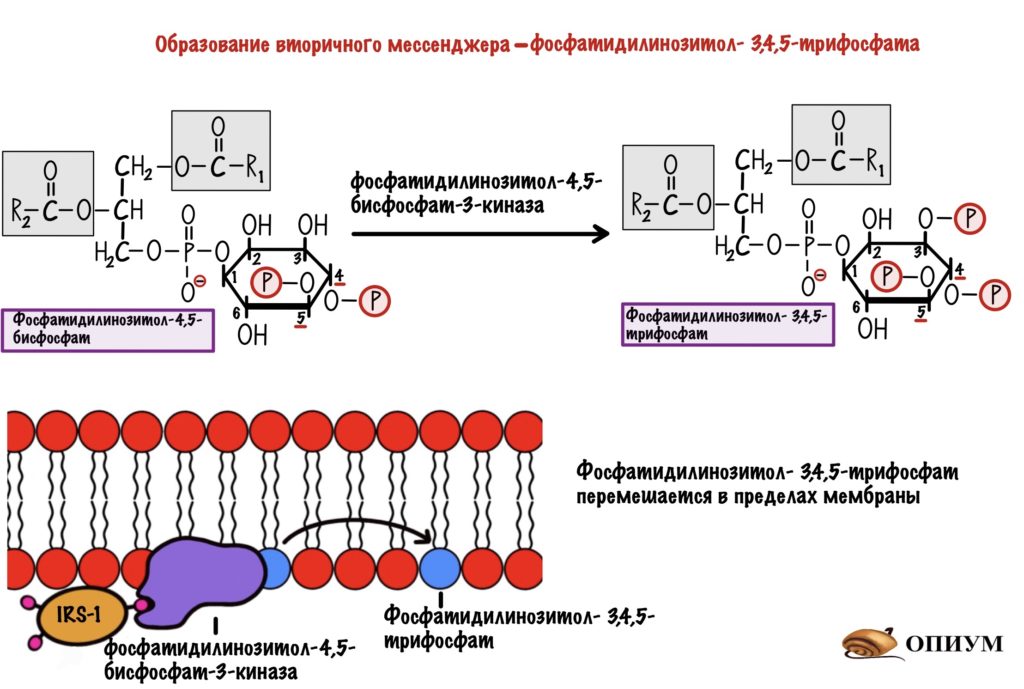
Дальше IRS присоединяется к протеинкиназе. Название будет довольно сложным, но знакомым — фосфатидилинозитол-4,5-бисфосфат-3-киназа. Наш старый друг снова здесь! Правда после него идёт какая-то киназа, но сейчас разберёмся.
Задача любой киназы — присоединить фосфорный остаток к субстрату. Вот эта киназа и присоединяет фосфорный остаток к нашему корешу. Но здесь не образуется какого-то водорастворимого мессенджера. Фосфатидилинозитол-3,4,5-трифосфат может перемещаться только в пределах мембраны. И это наш вторичный мессенджер.
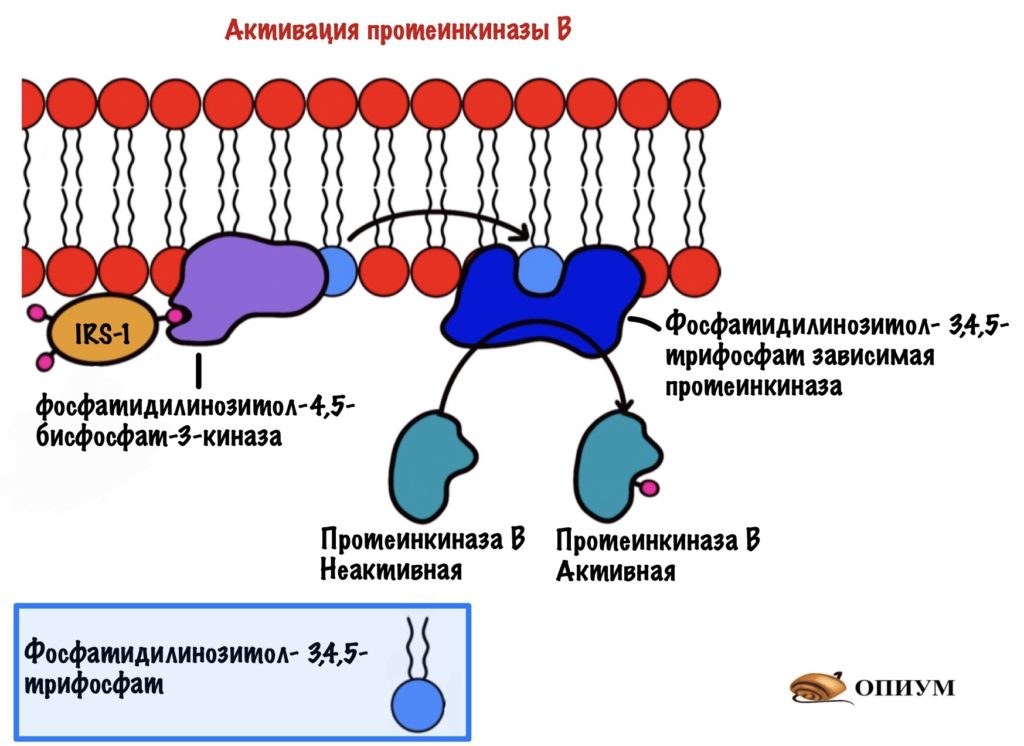
Фосфатидилинозитол-трифосфат перемещается по мембране, пока не наткнётся на фосфатидилинозитол-3,4,5-трифосфат зависимую протеинкиназу. А как наткнётся, так сразу же её и активирует. Эта протеинкиназа занимается тем, что фосфорилирует протеинкиназу B переводя её в активное состояние. Протеинкиназа B — одна из немногих протеинкиназ, которая не связана с мембраной. Она может путешествовать по клетке и активировать другие белки и ферменты. А значит она обеспечивает более глобальный клеточный ответ — ведь может активировать больше белков и ферментов.
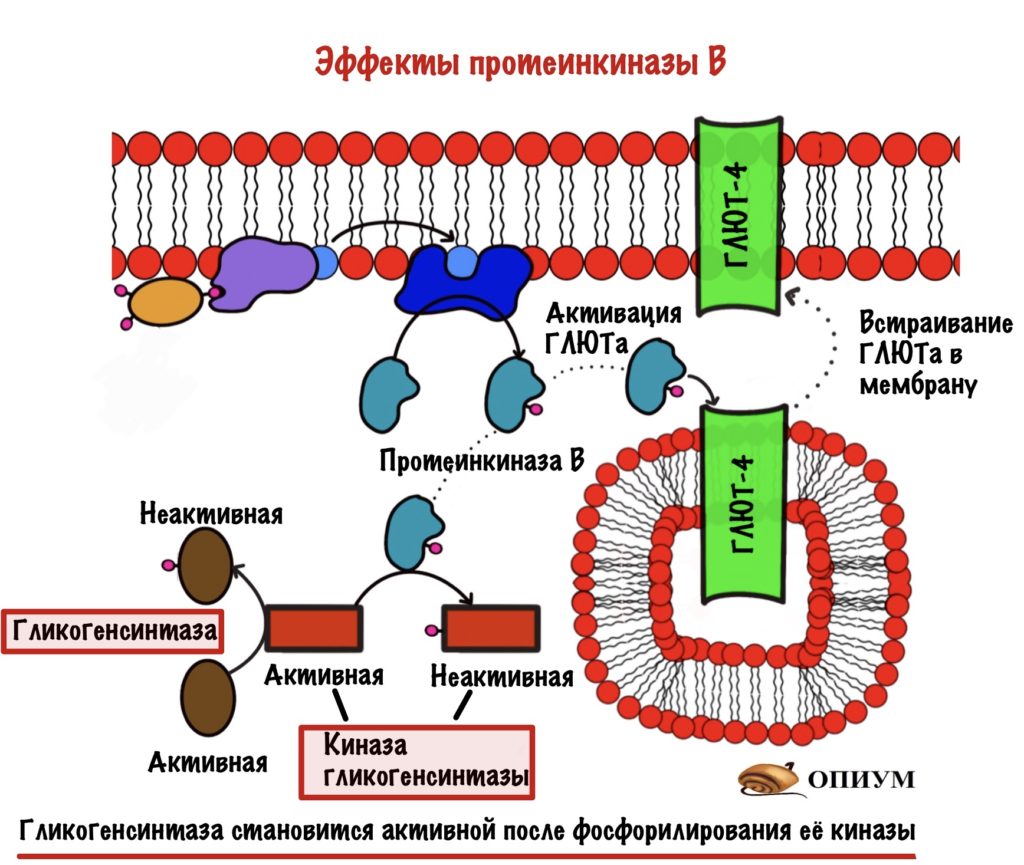
Самое важное для нас то, что она:
- Активирует белки переносчики глюкозы — ГЛЮТы, а именно ГЛЮТы 4 типа. Они встраиваются в мембрану скелетных мышц и начинают перемещать глюкозу внутрь клетки.
- Фосфорилирует киназу гликогенсинтазы, переводя её в неактивную форму. В активной (дефосфорилированной форме) киназа гликогенсинтазы занимается фосфорилированием гликогенсинтазы, что делает ее неактивной. Она активна в дефосфорилированном состоянии!!!
Это был первый путь и вот общая схемка.
А че по ядру?
А по ядру…. Ну готовьтесь к куче новых белков, особенно киназ!
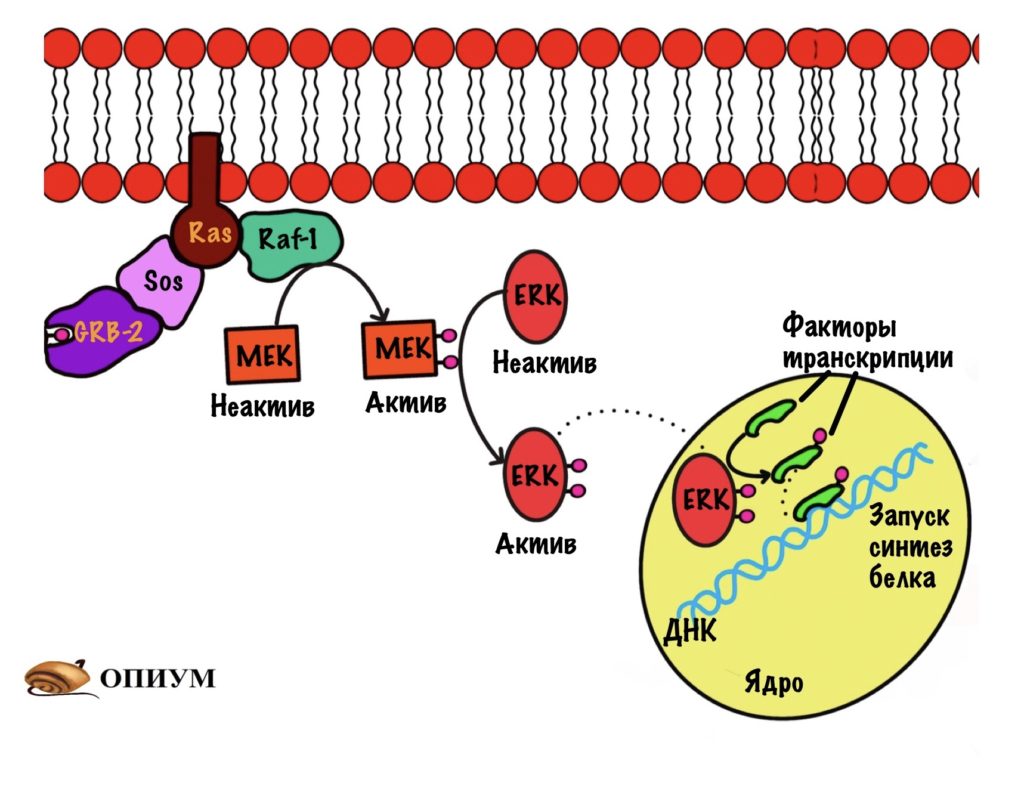
Ещё раз присоединяем инсулин и запускаем аутофосфорилирование рецептора. Дальше фосфорилируем IRS-1 — теперь он может присоединять другие белки, а их будет несколько. Первый из них — Grb-2, он связывается с IRS-1, но ничего особо не делает. После этого к Grb-2 белку присоединяется белок Sos. Белок Sos занимается заменой ГДФ на ГТФ у белка Ras.
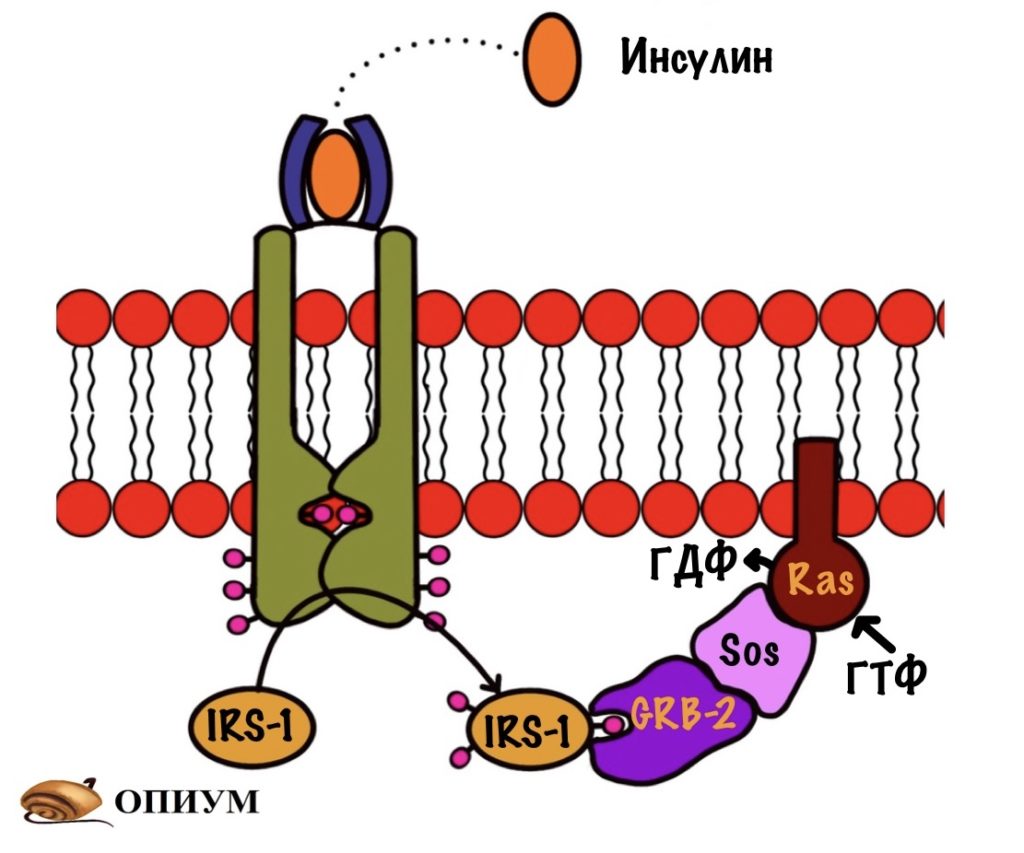

Ras — это мембранный белок, он относится к малым G-белкам. Они состоят только из одной субъединицы, которая связана с ГДФ/ГТФ. Ras активируется при присоединении к нему ГТФ и связывается со следующим белком RAF-1. Это просто протеинкиназа — дальше будут только они. RAF-1 активирует фосфорилированием следующую киназу — MEK. А MEK фосфорилирует ERK и переводит её в активное состояние. ERK направляется в ядро, где занимается фосфорилированием факторов транскрипции. Он переводит их в активное состояние. Так инсулин действует на ядро и вызывает синтез белка. Этот механизм стимулирует синтез ферментов и белков, которые ответственны за рост и деление клеток.
По такому же принципу действуют и другие сигнальные молекулы, например — эпидермальный фактор роста. Рецепторы отличаются строением, но сам механизм такой же.
И ещё одно, инсулин регулирует факторы транскрипции не только через ERK. Протеинкиназа B тоже вызывает фосфорилирование факторов транскрипции, например PDX1. Этот фактор ответственен за синтез ферментов метаболизма углеводов и жиров.
Понимаю, что это довольно сложно. Но смысл в том, чтобы запустить как можно больше киназ. А эти киназы с максимальной силой подействуют на ядро. Поэтому амплификация особенно важна для таких рецепторов. Но запомнить все эти белки и киназы как-то сложновато. Организм не мог сделать попроще? Видимо не мог, но нам главное понять принцип — это эстафета, каждый этап которой увеличивает действие сигнала.
Рецепторы с гуанилатциклазной активностью
Рецептор обладает ферментативной активностью — превращает ГТФ в цГМФ. При присоединении сигнальной молекулы он изменяет свою конформацию, что приводит к его активации. Рецептор начинает синтезировать цГМФ, которая активирует протеинкиназу G. А она там дальше занимается фосфорилированием белков и ферментов. Не будем так подробно разбираться с этим. Просто приведу пару примеров.
По такому механизму действует предсердный натрийуретический пептид. Через активацию протеинкиназы G он увеличивает экскрекцию натрия в мочу, а значит и воды. Этим он снижает давление — через снижение сердечного выброса.
Ещё есть внутриклеточные рецепторы с гуанилатциклазной активностью. Их активируют жирорастворимые молекулы, например NO. Важная сигнальная молекула, которая снижает потребность миокарда в кислороде. А делает она это через активацию протеинкиназы G, которая активирует Ca-насосы — вызывает снижение Ca внутри клетки. А значит и снижается сила сокращений.
По такому принципу работают нитраты — нитроглицерин, нитропруссид натрия и другие. Они увеличивают образование NO, но уже не эндогенного. А он активирует гуанилатциклазу, ну а дальше вы знаете.
Взаимосвязь тирозинкиназных рецепторов и рецепторов, связанных с G-белками
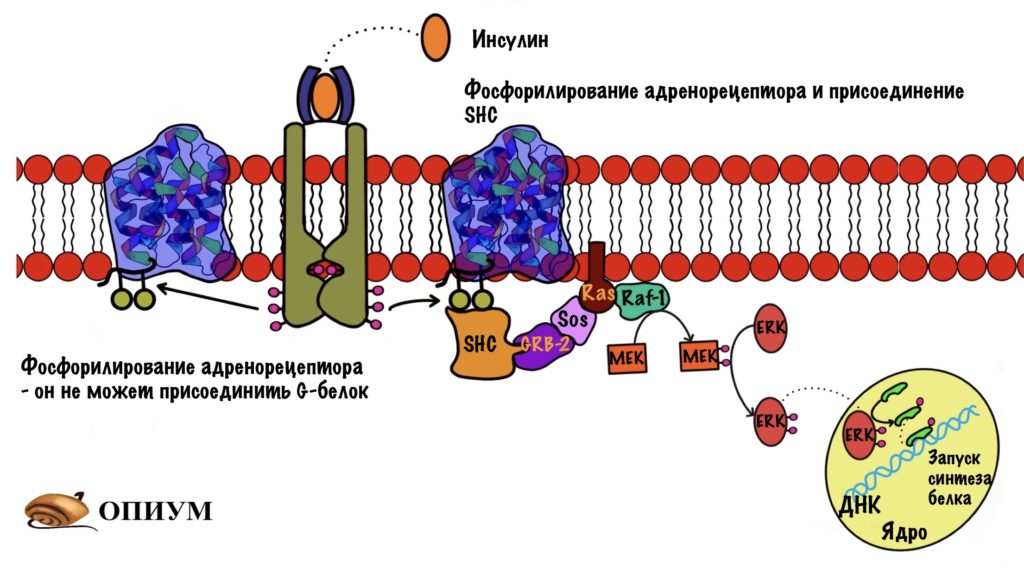
Мы все разбираем отдельно для того, чтобы не запутаться. В организме все идёт посложнее. Давайте посмотрим, что случится с рецепторами, связанными с G-белками при действии инсулина. Инсулин активирует тирозинкиназную способность своих рецепторов, они начинают фосфорилировать всё, что им попадётся с остатком тирозина. Если им попадётся бета-адренорецептор, то они фосфорилируют его. Так он потеряет способность соединяться со своим G-белком, поэтому влияние адреналина на клетку снизится.
Есть и другой вариант. Фосфорилирование рецептора приведёт к присоединению к нему SHC белка, такой аналог IRS-1. SHC белок присоединяет Grb2, а тот присоединяет Sos — дальше вы уже знаете.
Это только малая часть взаимодействий. Нужно понять, что сигнальные молекулы взаимодействуют друг с другом. Клеточный ответ зависит от того, какие сигнальные молекулы действуют на клетку и какая у них концентрация. Если инсулина будет очень много, а адреналина мало, то в клетке будет преобладать анаболизм. Верно и наоборот. Но всё сложнее, когда действие примерно равно. Главное вынести суть — взаимодействие сигнальных молекул шутка сложная. Но это не значит, что его нет!
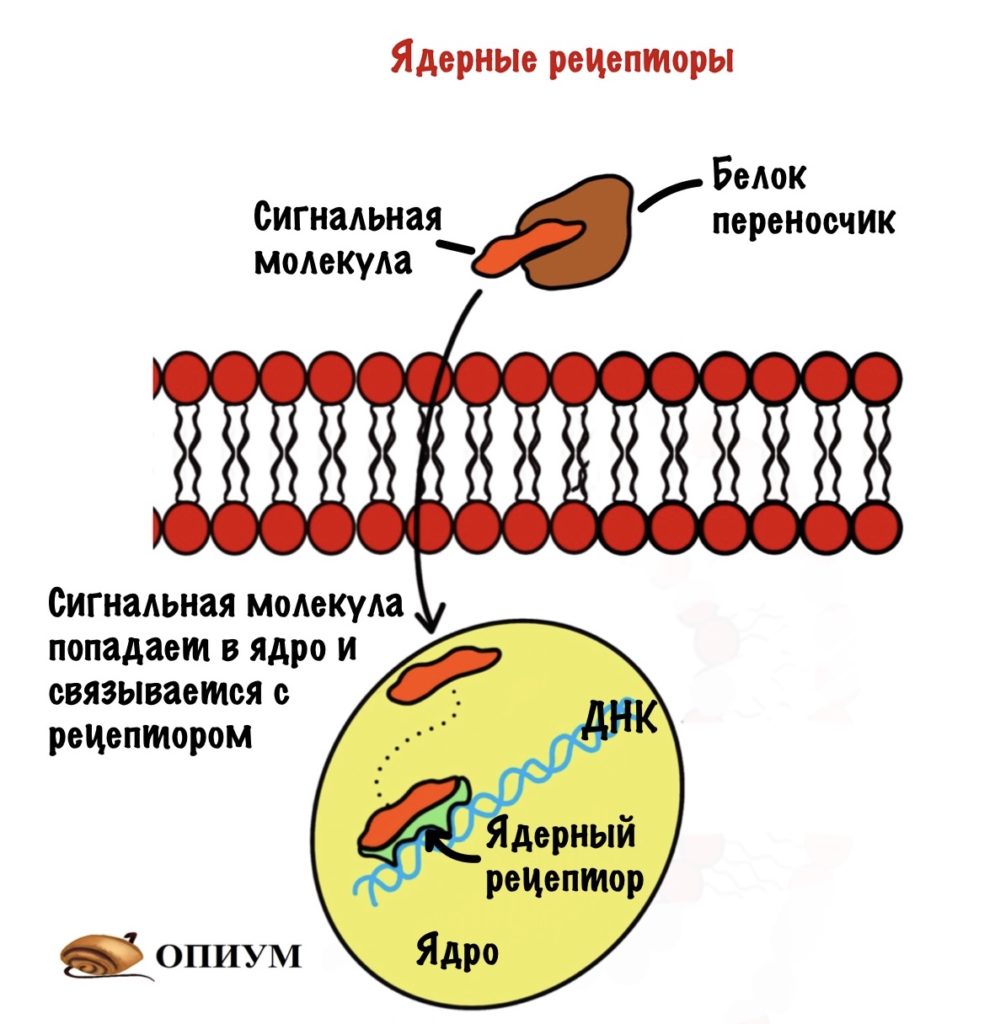
Ядерные рецепторы
Сигнальные молекулы для них — это липофильные вещества. Типо стероидных и тиреоидных гормонов. Так как эти гормоны не растворимы в воде, то для доставки их к тканям нужны белки-переносчики. Белки-переносчики транспортируют их тканям, а дальше они проходят через клеточную мембрану и доходят до ядра.
После они проходят через ядерную мембрану и попадают в ядро. Там для них есть рецепторы, с которыми они связываются. Образуется комплекс сигнальная молекула — рецептор, который присоединяется к регуляторным последовательностям ДНК. Они называются — элемент отклика гормона. При присоединении комплекса запускается синтез белка. Синтез белка процесс длительный, поэтому полный эффект от действия таких гормонов наступает через пару часов, а иногда и суток.
Не все сигнальные молекулы приводят к синтезу белка — некоторые, наоборот, блокируют его.