Челночные механизмы для НАДH
Эта тема входит в мой курс по биохимии
Челночные механизмы нужны для переноса электронов и протона водорода с НАДH в матрикс митохондрий. Почему эта молекула так важна, что для неё существуют отдельные механизмы?
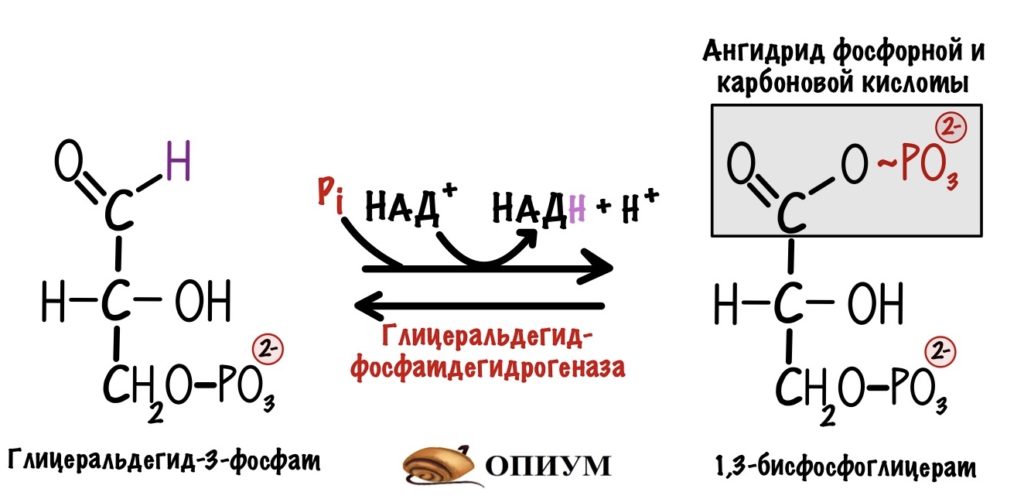
НАДH — это восстановленный кофермент. Он образовался в шестой реакции гликолиза, которую катализирует глицеральдегидфосфатдегидрогеназа. Для этой реакции в активном центре фермента должен находиться кофермент — НАД+. Кофермент принимает на себя два электрона и протон от глицеральдегид-3-фосфата. Так образуется восстановленный НАДH.
Шестая реакция гликолиза не пойдёт, если в активном центре фермента не будет НАД+. А это значит, что реакции гликолиза остановятся. Так, если следующая глюкоза попадает в гликолиз, то дальше пятой реакции дело не пойдёт. Клетка не получит то, ради чего всё затевалось: две молекулы АТФ, две молекулы пирувата и две молекулы НАДH. Обидно терять всё это богатство из-за одного кофермента.
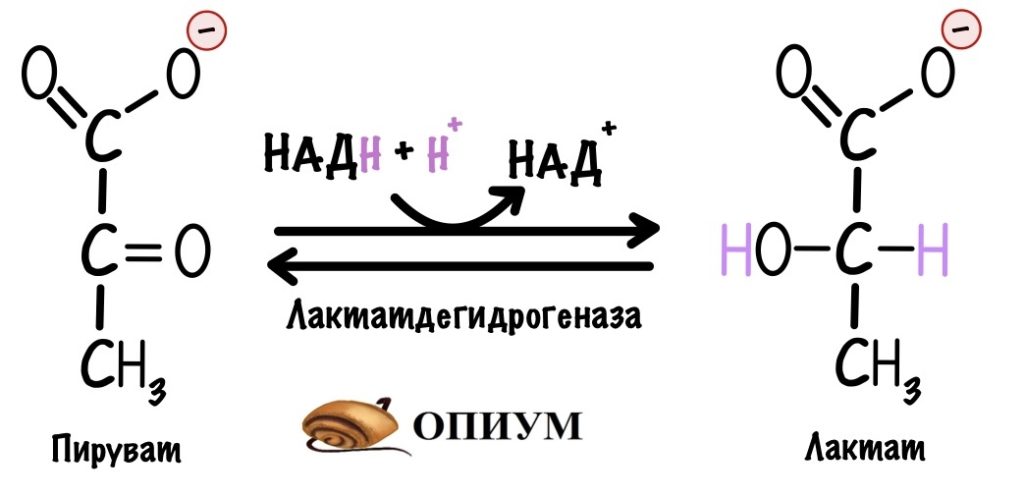
Тут нужно остановиться и вспомнить, что гликолиз идёт в цитоплазме клетки. Там НАДH можно окислить с помощью анаэробного гликолиза. Но клетку такое интересует не часто. Из-за анаэробного гликолиза она теряет две молекулы пирувата, которые пойдут на синтез лактата. Эту реакцию катализирует лактатдегидрогеназа. С помощью неё НАДH окисляется до НАД+. Эта реакция очень полезна в мышцах, когда им не хватает кислорода, и эритроцитах. НО остаётся огромный минус — клетка не получит пируват. Он не отправится в цикл трикарбоновых кислот и дыхательную цепь, а значит куча энергии пропадёт даром.
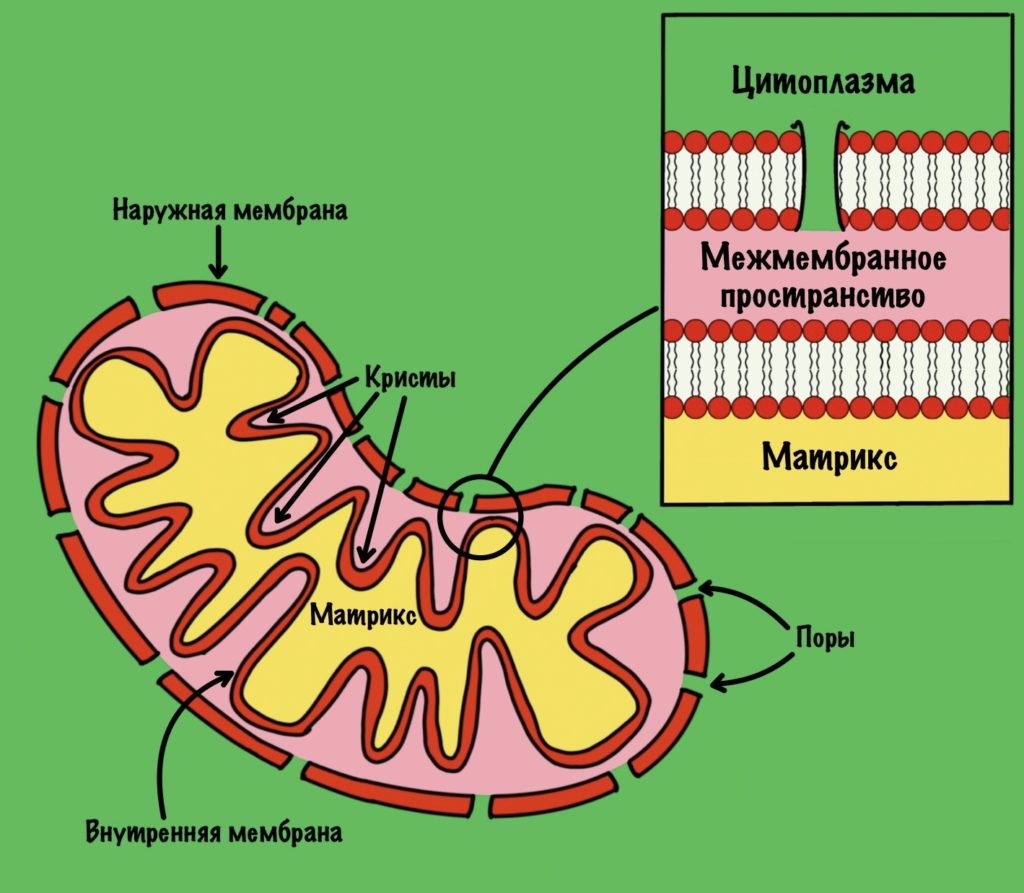
Нужен лучший способ окислить НАДH до НАД+, при котором мы не пожертвуем двумя молекулами пирувата. Для этого есть митохондрия, которая отделена двумя биологическими мембранами от цитоплазмы. Там основная энергетическая топка нашей клетки. При наличии кислорода восстановленные коферменты (НАДH и ФАДH2) окисляются в дыхательной цепи.
И вроде всё просто — давайте перекинем туда НАДH и дело с концом. Пусть он там окисляется, а потом возвращается в цитоплазму. Но тут есть проблема. Во внешней мембране митохондрий есть поры. Через них могу проходить небольшие молекулы, но вот внутренняя мембрана непроницаема. Поэтому НАДH и НАД+ не могут проникнуть через неё.
Нужно придумать какой-то механизм, благодаря которому НАДH будет переноситься через внутреннюю мембрану в матрикс митохондрии. Клетка запарилась, но придумала. Её идея ужасно проста, но очень умна (как и всегда). Что если переносить два электрона и протон с НАДH на другую молекулу? Эта молекула должна проходить через одну или две мембраны. Там отдавать электроны и протоны, а потом возвращаться обратно в цитоплазму. И так по кругу.
В общем-то вы уже поняли суть челночных механизмов, а теперь познакомимся с ними поближе. Всего таких механизмов два: глицеролфосфатный и малат-аспартатный.
Глицеролфосфатный челночный механизм
Работает в скелетных мышцах. Давайте посмотрим на общую картинку этого челнока.
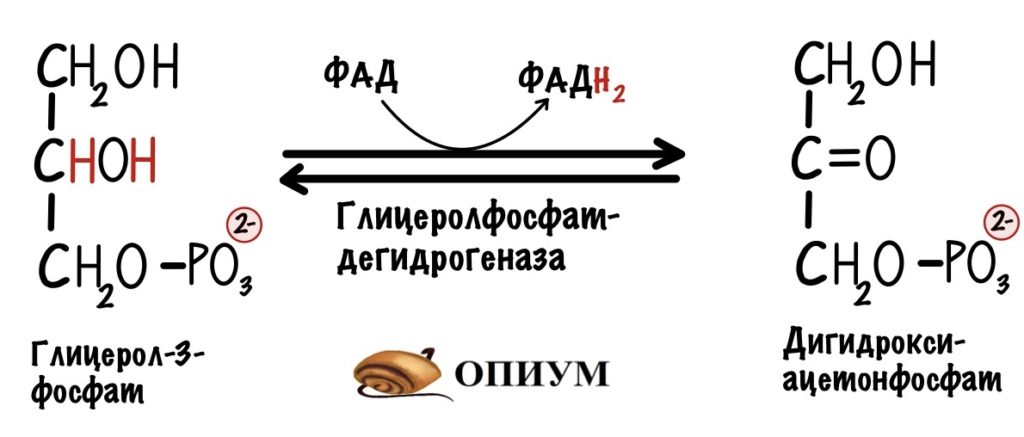
Первый этап катализирует цитоплазматическая глицерол-3-фосфатдегидрогеназа. Фермент присоединяет два электрона и два протона к дигидроксиацентофосфату. Образуется глицерол-3-фосфат и НАД+.
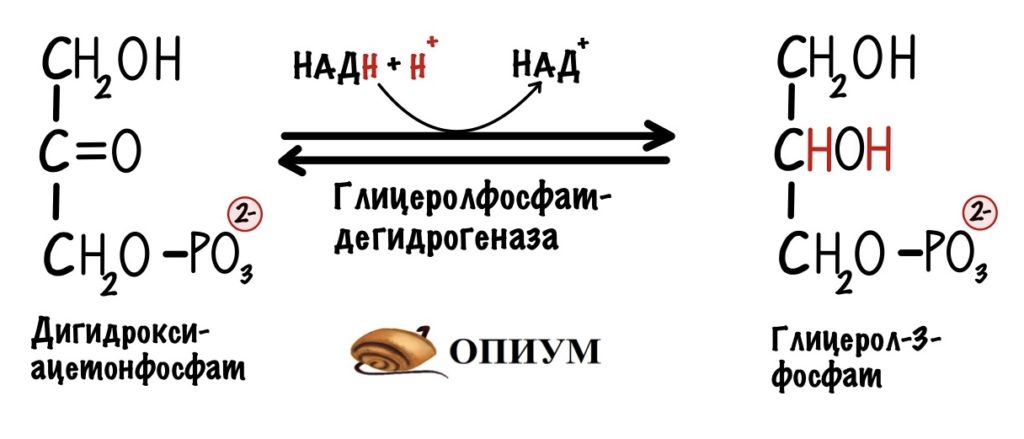

Два электрона и протон отдаёт НАДH, а второй протон берётся из цитоплазмы. Но их там не мало. Не запутайтесь в названиях: здесь образуется глицерол-3-фосфат, а не глицеральдегид-3-фосфат из гликолиза.
НАД+ остаётся в цитоплазме, где может снова использоваться в шестой реакции гликолиза.
На втором этапе глицерол-3-фосфат проходит через внешнюю мембрану и попадает в межмембранное пространство митохондрии. Там идёт третий этап челночного механизма. Катализирует его митохондриальная глицерол-3-фосфатдегидрогеназа. Фермент находится во внутренней мембране митохондрий. Эта реакция — зеркальное отражение прошлой. Из глицерол-3-фосфата образуется дигидроксиацетонфосфат. Два электрона и два протона принимает кофермент ФАД. Мы получаем дигидроксиацетонфосфат и восстановленный ФАДH2.
Четвёртый этап. Дигидроксиацетонфосфат покидает межмембранное пространство — снова оказывается в цитоплазме. Он опять может повторить цикл.
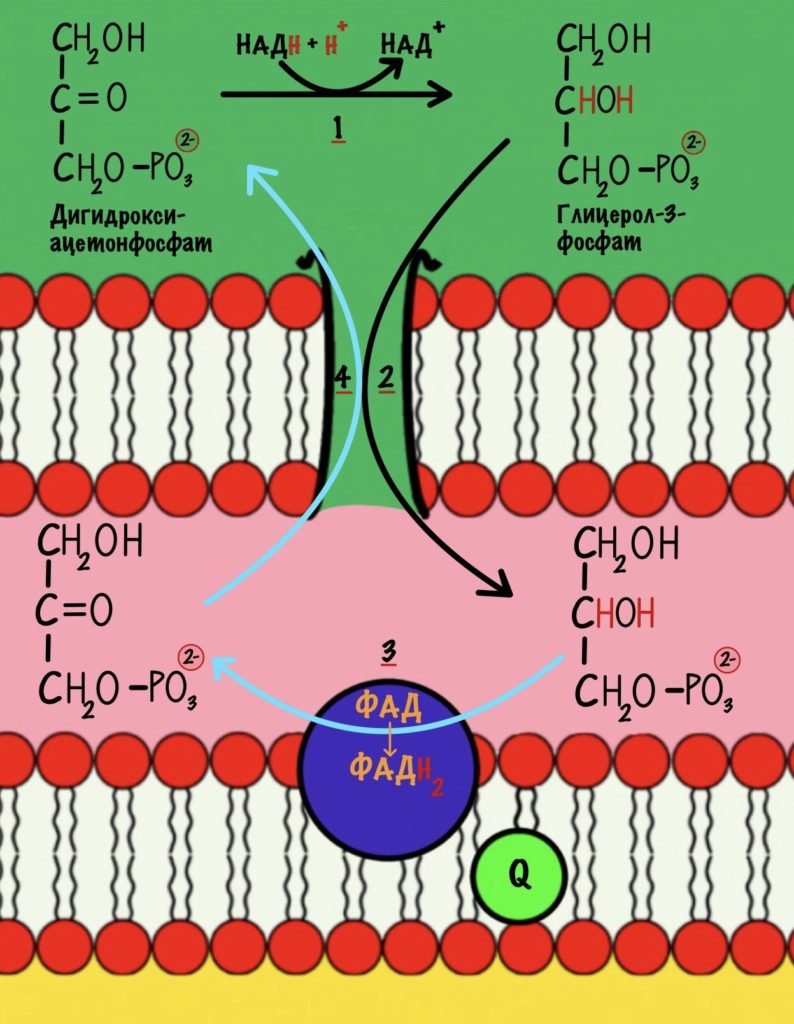


Вот так мы окислили НАДH до НАД+ и перенесли его два электрона и протон в митохондрию. А ещё мы захватили один протон из цитоплазмы, но от неё не убудет. Дальше митохондриальная глицерофосфатдегидрогеназа отдаст два электрона на убихинон, который отправится на третий комплекс дыхательной цепи.
Малат-аспартатный челночный механизм
Работает в большинстве органов и тканей, для нас самые важные — печень и сердце. В нём больше реакций, чем в прошлом челноке. Так что он посложнее.
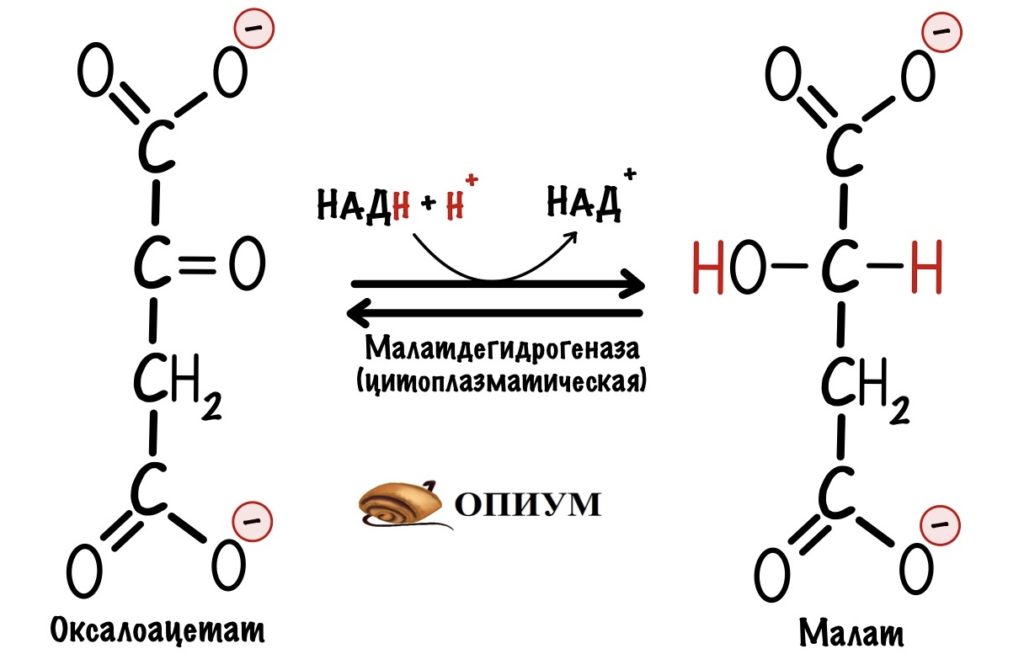
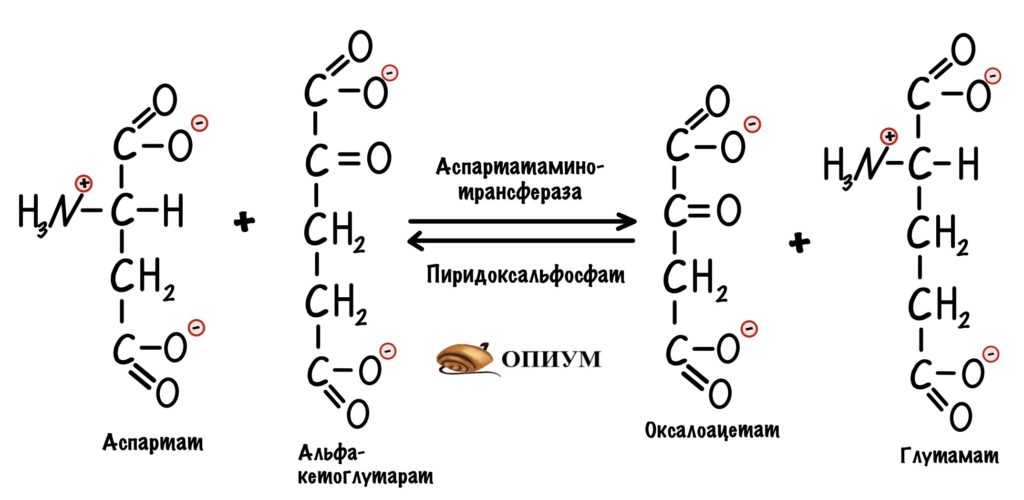
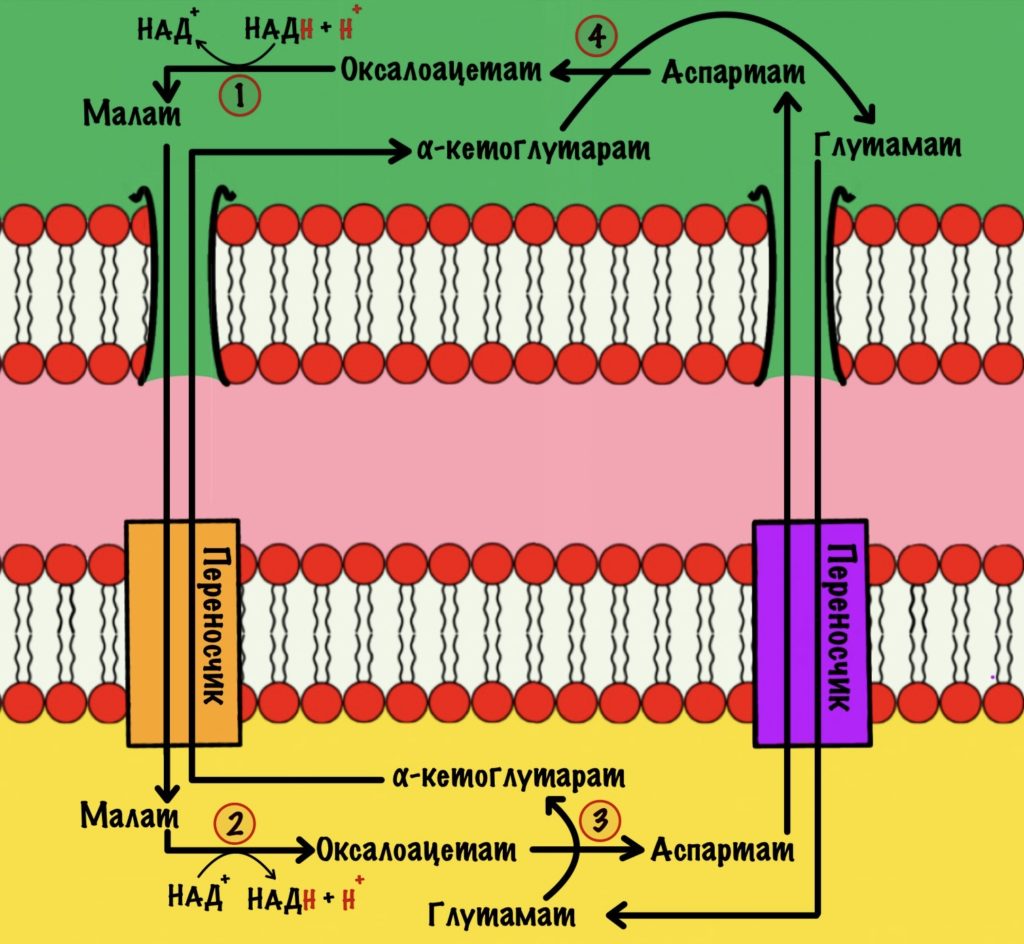
Первый этап. Электроны и протоны принимает оксалоацетат, который находится в цитоплазме. Катализирует реакцию цитоплазматическая малатдегидрогеназа. Клетка получает окисленный НАД+ и малат. НАД+ снова идёт в гликолиз. У малата не такая простая судьба.
Малат проходит через внешнюю мембрану митохондрии, но не может пройти через внутреннюю. Для него есть специальный белок переносчик: малат-α-кетоглутарат транслоказа. При её работе малат перемещается в матрикс митохондрий, а альфа-кетоглутарат в межмембранное пространство. Напоминаю, что такой транспорт называется антипортом. Из межмембранного пространства альфа-кетоглутарат может попасть в цитоплазму. Скажу даже больше, он туда попадает…
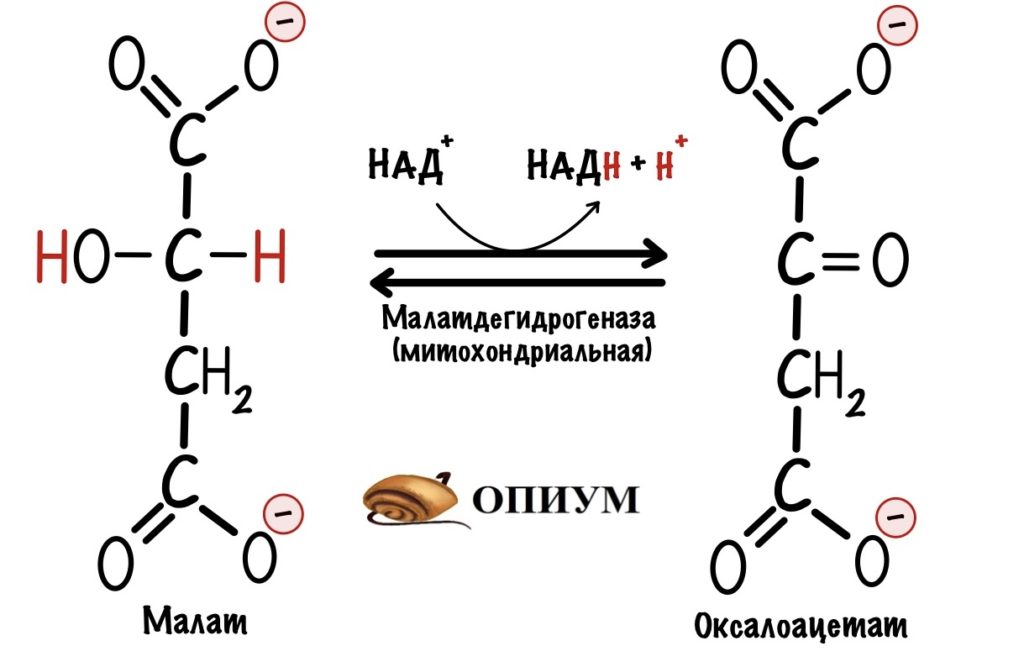
Второй этап. Малат превращается в оксалоацетат с помощью митохондриальной малатдегидрогеназы. Кофермент этой реакции НАД+, а не ФАД. Образуется НАДH, оксалоацетат и протон. Нужно запомнить, что в малат-аспартатном челноке используется кофермент НАД+.
Теперь нужно вернуть оксалоацетат в цитоплазму, но внутренняя мембрана митохондрии для него непроницаема. Это связано с тем, что он участвует в цикле трикарбоновых кислот. А он как раз идёт в матриксе митохондрий. Поэтому клетка не хочет терять его просто так.
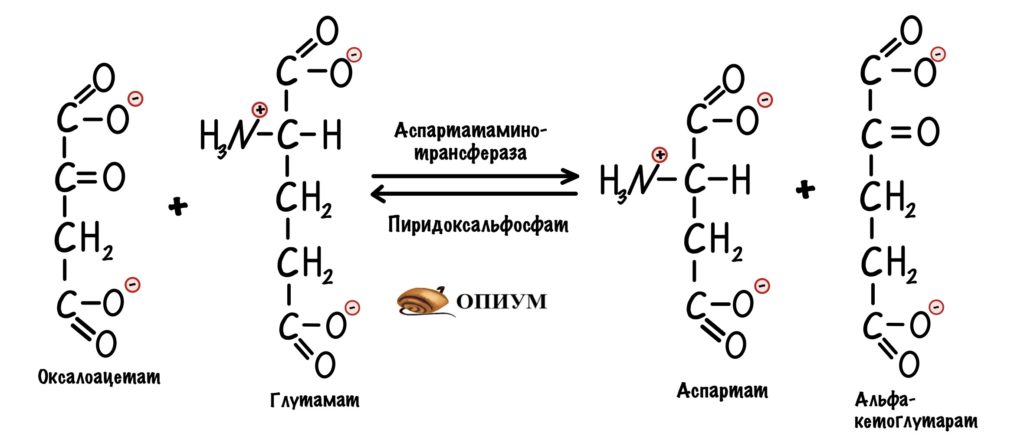
Третий этап. Для обхода этого защитного механизма есть дополнительная реакция. Эту реакцию катализирует митохондриальная аспартатаминотрансфераза. Фермент переносит аминогруппу с глутамата на оксалоацетат, для этого ему нужен кофермент — пиридоксальфосфат. Образуется аспартат и альфа-кетоглутарат.
Аспартат переносится через внутреннюю мембрану с помощью белка переносчика — глутамат-аспартат транслоказы. Она переносит аспартат в межмембранное пространство митохондрий, а глутамат в матрикс. Там глутамат используется для трансаминирования — мы видели это выше.
Четвёртый этап. Снова превращаем аспартат в оксалоацетат. Здесь нам понадобится альфа-кетоглутарат, который мы переносили в цитоплазму на первом этапе. Катализирует реакцию цитоплазматическая аспартатаминотрансфераза. Снова образуется оксалоацетат и глутамат. Оксалоацетат используется для малат-аспартатного челночного механизма, а глутамат переносится в митохондрию.

Цикл завершён. Мы перенесли электроны и протон с НАДH в матрикс митохондрии.

В челноках было много одинаковых по функциям ферментов. Но при этом у каждого была приписочка: цитоплазматический или митохондриальный. Дело в том, что это изоферменты — они выполняют одинаковую функцию, но при этом отличаются по аминокислотным последовательностям. А это значит, что они кодируются разными генами.
С аспартатаминотрансферазой (АСТ) вы встретитесь ещё миллиард раз. Она используется при диагностике инфаркта миокарда и заболеваний печени. А всё почему? Потому что там наибольшая активность малат-аспартатного челнока. Так что запоминайте этот фермент и не думайте, что биохимия бесполезна. Опять говорю как препод….
Что происходит с электронами дальше?
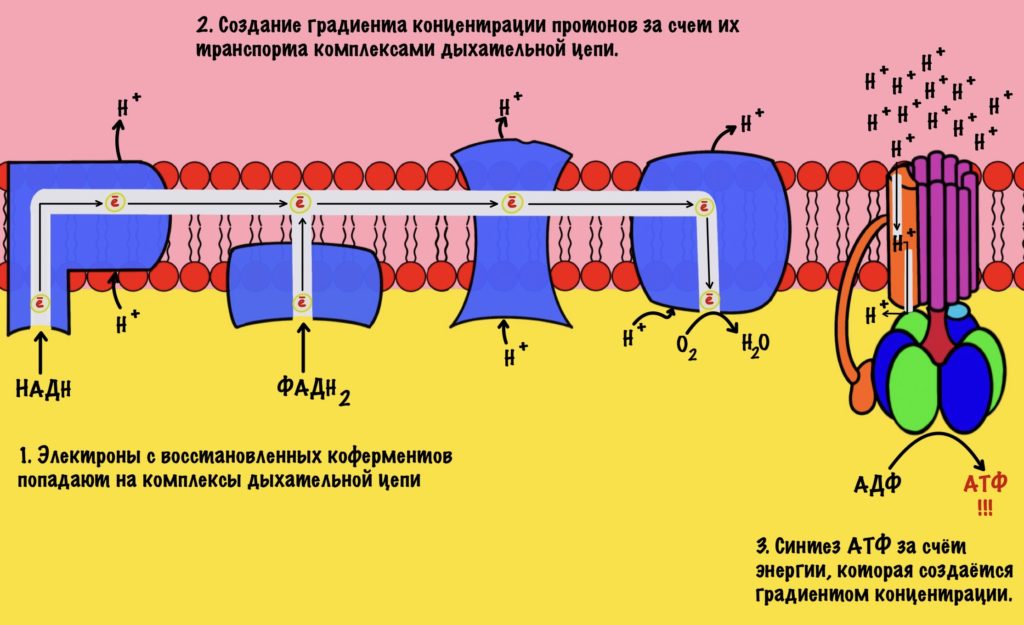
Смысл окисления НАДH до НАД+ не только в бесперебойной работе гликолиза. Электроны и протоны, которые были перенесены в матрикс митохондрий используются для синтеза АТФ. Как? С помощью дыхательной цепи. Я не буду расписывать её ещё раз, если хотите подробнее, то о ней можно почитать тут. Главное сейчас — это понять суть.
Электроны переносятся от одного комплекса дыхательной цепи к другому, пока они не попадут на кислород. В ходе такого переноса выделяется энергия. Эта энергия используется для транспорта протонов водорода из матрикса митохондрий в межмембранное пространство. Так создаётся градиент концентрации. Внутри митохондрии протонов мало, а снаружи много. При этом первый комплекс выкачивает четыре протона, третий тоже четыре, а четвёртый только два протона. Градиент концентрации используется на синтез АТФ с помощью АТФ-синтазы. На синтез одной молекулы АТФ затрачивается ~ четыре протона.
В глицеролфосфатном челноке мы получили ФАДH2. Электроны с него попадают сразу на убихинон, то есть пропускают первый комплекс дыхательной цепи. Значит в ходе путешествия электронов по дыхательной цепи мы получим всего шесть протонов водорода. Или 1,5 молекулы АТФ — на синтез одной молекулы нужно четыре протона. Это из одного ФАДH2. Но в ходе гликолиза образовались две молекулы НАДH, а значит мы получим две молекулы ФАДH2. Умножим 1,5 на 2 и получим три молекулы АТФ — из каждого ФАДH2 по 1,5 АТФ. Прибавим две, которые мы получили в ходе гликолиза. И выйдет пять молекул АТФ. Это общий выход гликолиза при использовании глицеролфосфатного челнока.
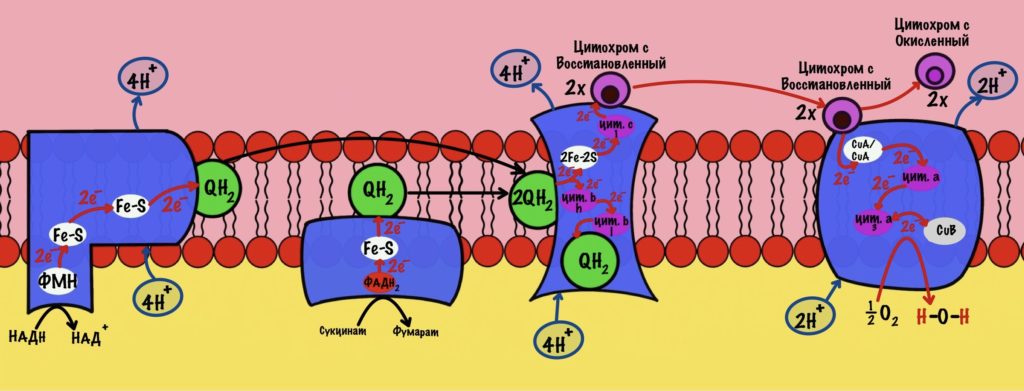

В ходе малат-аспартатного челнока был получен НАДH. Он отдаёт электроны на первый комплекс дыхательной цепи. Значит общее количество протонов — десять. Или 2,5 молекулы АТФ. В ходе гликолиза мы получили два НАДH, а значит и здесь их будет два. Общее количество АТФ — пять. Прибавим две, которые мы получили в ходе гликолиза. Выходит семь молекул АТФ. Это общий выход гликолиза при использовании малат-аспартатного челнока.