Синтез и распад гликогена
Эта тема входит в мой курс по биохимии
Гликоген — это форма хранения глюкозы в нашем организме. Сначала поговорим про его строение. Куда нам лезть к его синтезу и распаду, если мы не знаем с чем работаем?
Строение гликогена
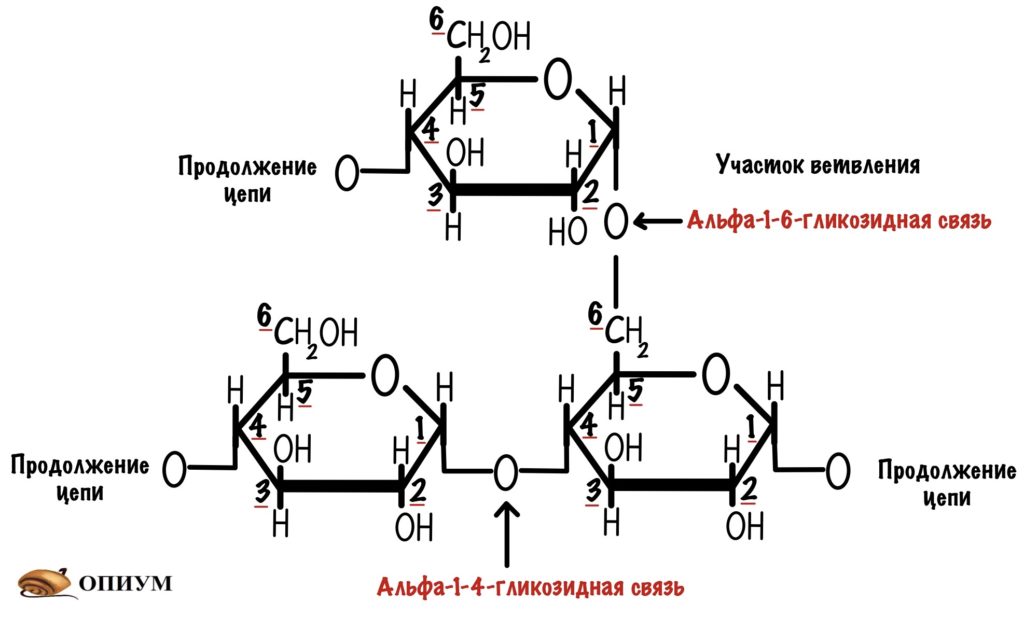
Гликоген — это полисахарид, с помощью которого мы запасаем энергию. Если это полисахарид, то он состоит из моносахаридов. Такой моносахарид для гликогена — глюкоза. А если точнее, то D-альфа-глюкоза.
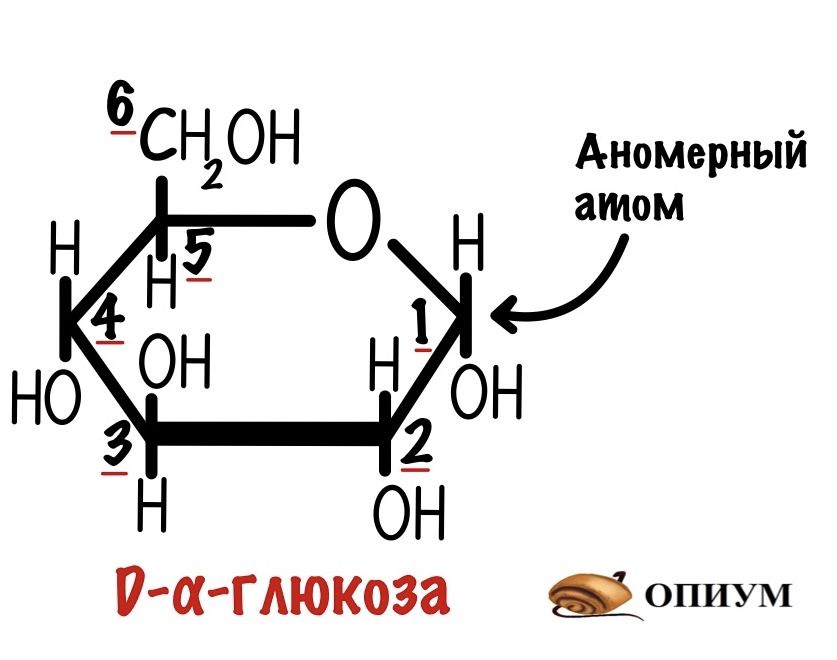

Молекулы глюкозы связаны друг с другом с помощью О-гликозидных связей. Есть два вида связей: альфа-1-4-гликозидная и альфа-1-6-гликозидная.
С помощью альфа-1-6-гликозидной связи гликоген ветвится, такое ветвление происходит примерно через каждые десять остатков глюкозы. Но может быть и меньше.
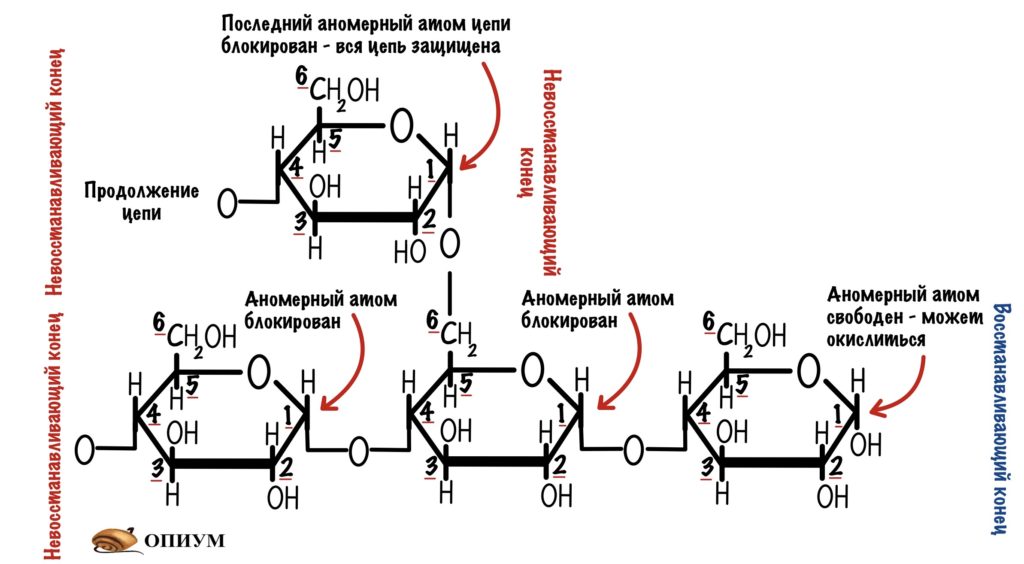
Для чего нужно ветвление? Давайте ещё раз посмотрим на гликозидные связи. Мы видим, что альфа-1-4-гликозидная связь образуется между аномерным атомом углерода первой молекулы и четвёртым атомом другой молекулы. Так аномерный атом защищается от окисления. Но при этом аномерный атом второй молекулы попадает под удар. Поэтому у молекулы есть восстанавливающий конец — он может окисляться, и невосстанавливающий — он не окисляется.
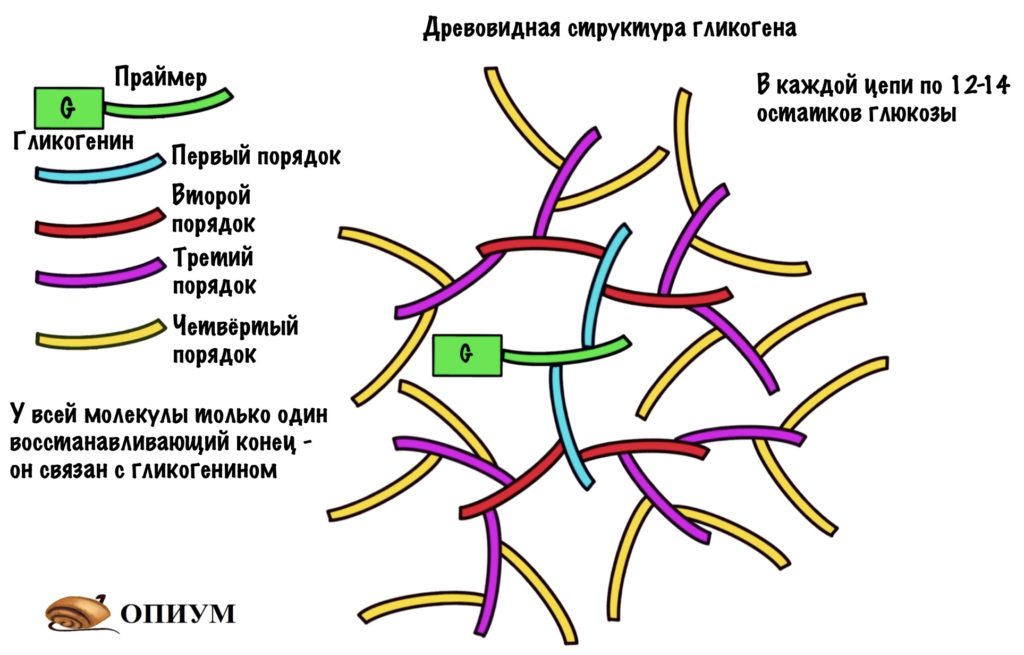
При образовании альфа-1-6-гликозидной связи цепь замыкается. Сверху была цепь с восстанавливающим концом, но при ветвлении этот конец блокируется. Его теперь не окислить. В ветвящуюся цепь входит 12-14 остатков глюкозы. Получается, что гликоген образует огромную древовидную структуру, у которой много невосстанавливающих концов. Так организм хранит свою глюкозу и не даёт ей испортиться.
Закину небольшой спойлер — ферменты, которые отвечают за синтез и распад гликогена действуют с невосстанавливающих концов. Поэтому ветвление увеличивает их эффективность. Так они могут взяться за работу сразу с множества сторон.
Где хранится гликоген и большой ли у нас запас?
Гликоген хранится в мышечной ткани и печени. Но эти запасы не одинаковы по количеству и функциям. Мышечная ткань эгоистка, она хранит гликоген только для себя. Он нужен ей для сокращений. Гликогена в мышцах хватает где-то на час физической работы.
Печень же альтруистка, она хранит гликоген для всего организма. Между приёмами пищи она разрушает гликоген и выкидывает глюкозу в кровь. Это важно, потому что наш мозг от неё зависит. Так уж получается, что мы зависим от него. Другим клеткам тоже достаётся глюкоза, но не так много как мозгу. Запаса в печени хватит от двенадцати до двадцати четырёх часов. Не слишком много, но во время приёмов пищи этот запас восстанавливается.
Распад гликогена или гликогенолиз
Давайте подумаем, что нам нужно получить в ходе гликогенолиза. Свободную глюкозу? Нет, она может выскочить из клетки. Это было бы полезно для печени, но не для мышц — этих эгоисток. Нужно получить что-то универсальное — мы сможем направить это на гликолиз, но при этом легко превратить в глюкозу. Такая молекула у нас есть — глюкозо-6-фосфат. Его можно сразу же отправить в топку для получения энергии, а можно дефосфорилировать и получить глюкозу. Так что наша цель — получить глюкозо-6-фосфат в ходе распада гликогена.
В гликогенолизе задействованы всего три фермента: гликогенфосфорилаза, деветвящий фермент и фосфоглюкомутаза.
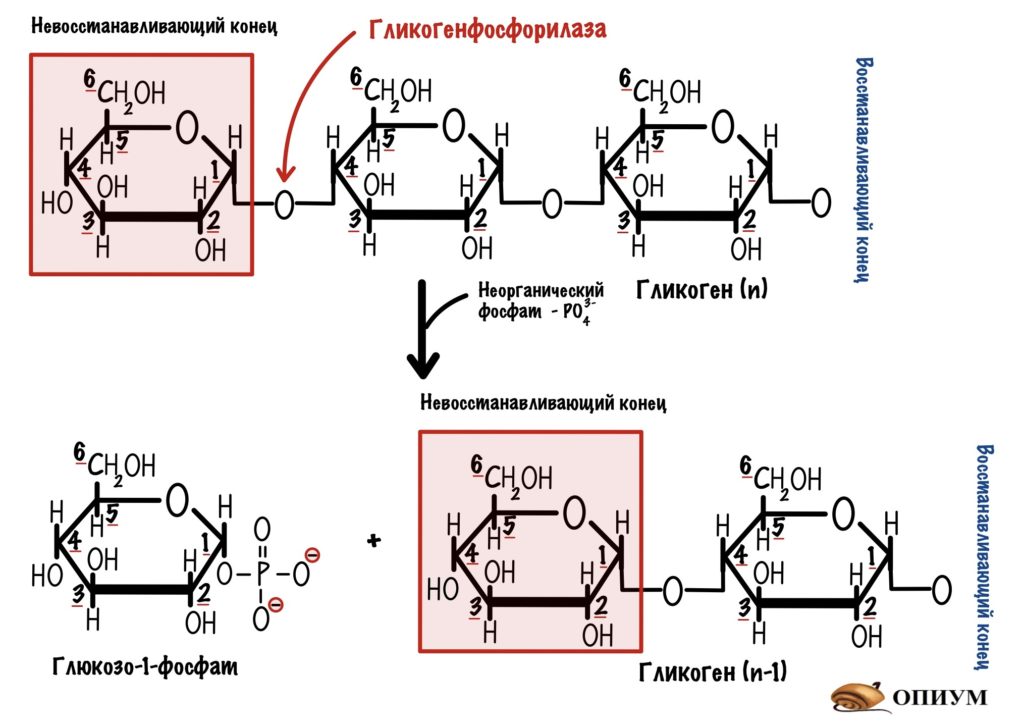
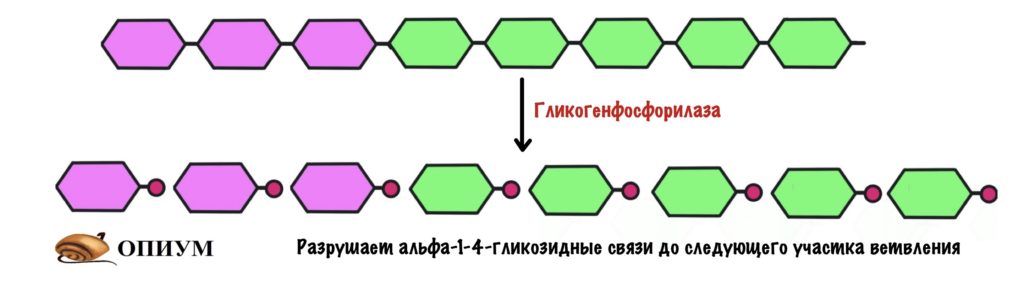
Гликогенфосфорилаза действует с невосстанавливающего конца. Какие там связи? Альфа-1-4-гликозидные — их нам и нужно порвать. Посмотрим на название фермента — фосфорилаза, значит здесь задействуется неорганический фосфат. Разрушение связи называется фосфоролизис, он отличается от гидролиза. При гидролизе в месте разрушения связи присоединяется молекула воды, а при фосфоролизисе — неорганический фосфат. Фосфат присоединяется по альфа-1-4-гликозидной связи. Связь разрушается, а мы получаем глюкозо-1-фосфат и гликоген, в котором меньше на одну молекулу глюкозы.
Такая реакция выгодна по двум причинам:
- Концентрация неорганического фосфата намного больше, чем концентрация глюкозо-1-фосфата. Это значит, что равновесие реакции смещается вправо — в сторону образования глюкозо-1-фосфата.
- Конформация глюкозо-1-фосфата энергетически выгодна.
Есть и ещё один плюс такой реакции: мы не тратим молекулу АТФ, а используем подручные средства — неорганический фосфат, которого и так много в клетке. Экономия!
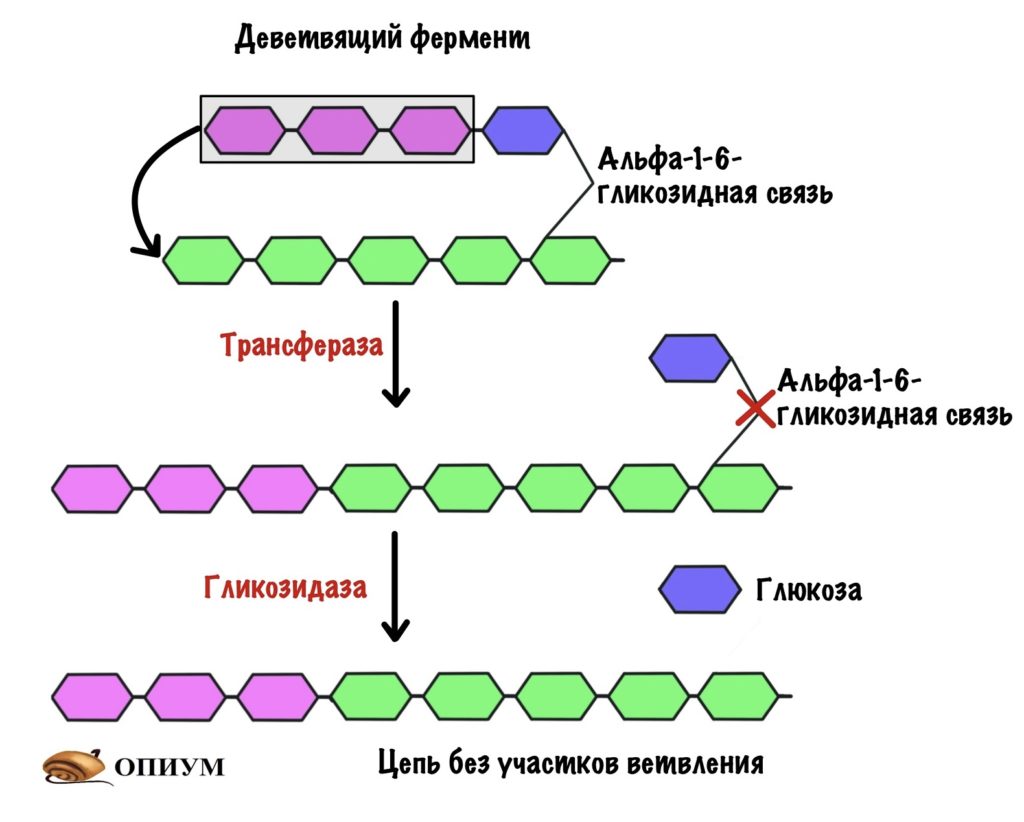
Гликогенфосфорилаза отлично справляется с разрушением альфа-1-4-гликозидных связей, но ведь в гликогене есть и другие связи — альфа-1-6-гликоиздные. С ними фосфорилазе не совладать. Фермент останавливается за четыре остатка глюкозы до ветвления. Это из-за строения активного центра гликогенфосфорилазы. Значит нам нужно убрать участок ветвления для того, чтобы гликогенфосфорилаза продолжила свою работу.
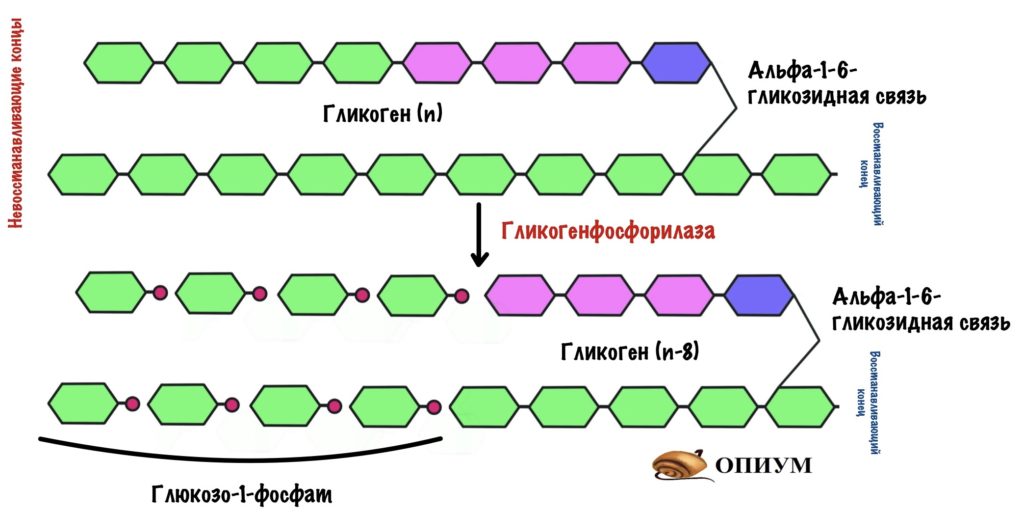

Помогает гликогенфосфорилазе наш второй фермент — деветвящий. Это даже не фермент, а комплекс из двух ферментов: трансферазы и гликозидазы. По их названию понятно, что первый занимается переносом чего-то, а второй — гидролизом гликозидной связи.
Трансфераза переносит три остатка глюкозы с участка ветвления на другую цепь. Но альфа-1-6-гликозидная связь всё еще остаётся. Гликозидаза гидролизует альфа-1-6-гликозидную связь и высвобождает свободную глюкозу.
Цепь становится ровной — без участков ветвления. Снова задействуется гликогенфосфорилаза, которая разрушает гликоген до следующего участка ветвления.
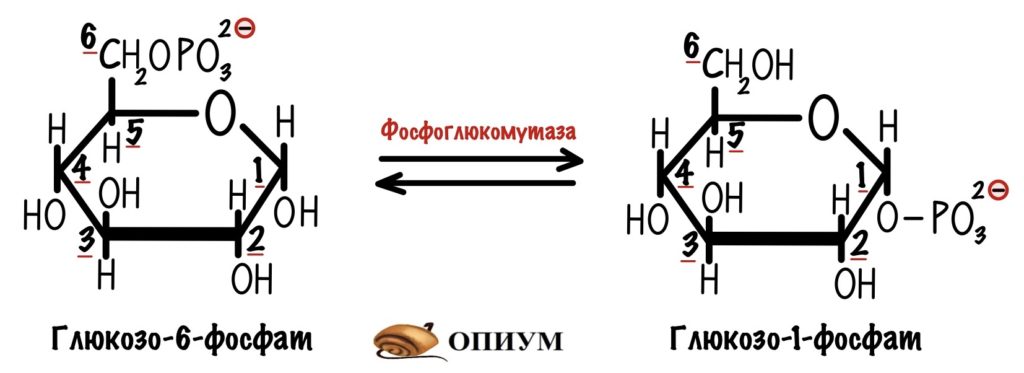
В итоге мы получаем глюкозо-1-фосфат, который нужно превратить в глюкозо-6-фосфат. Это задача для фосфоглюкомутазы. В её активном центре есть серин, который связан с фосфатной группой. Реакция идёт в два этапа: сначала фосфатная группа переносится на шестой атом углерода — мы получаем бисфосфат. Потом фосфатная группа переносится с первого атома на сериновую группу — мы получаем глюкозо-6-фосфат. А фермент может снова повторить цикл со следующей молекулой.
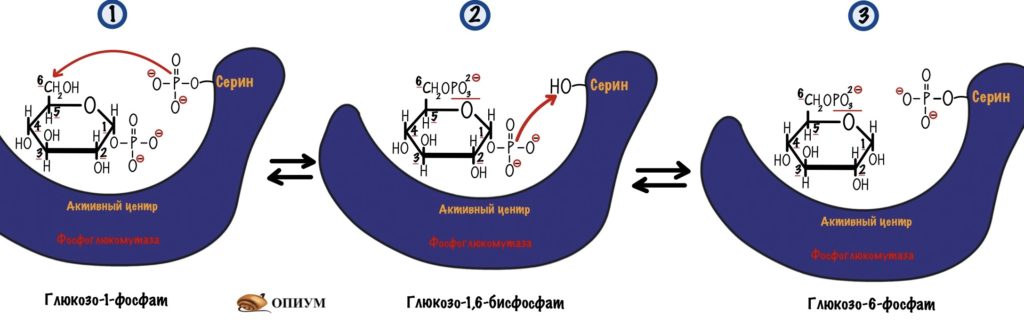

Этим заканчивается распад гликогена — образованием глюкозо-6-фосфата.
Что дальше?
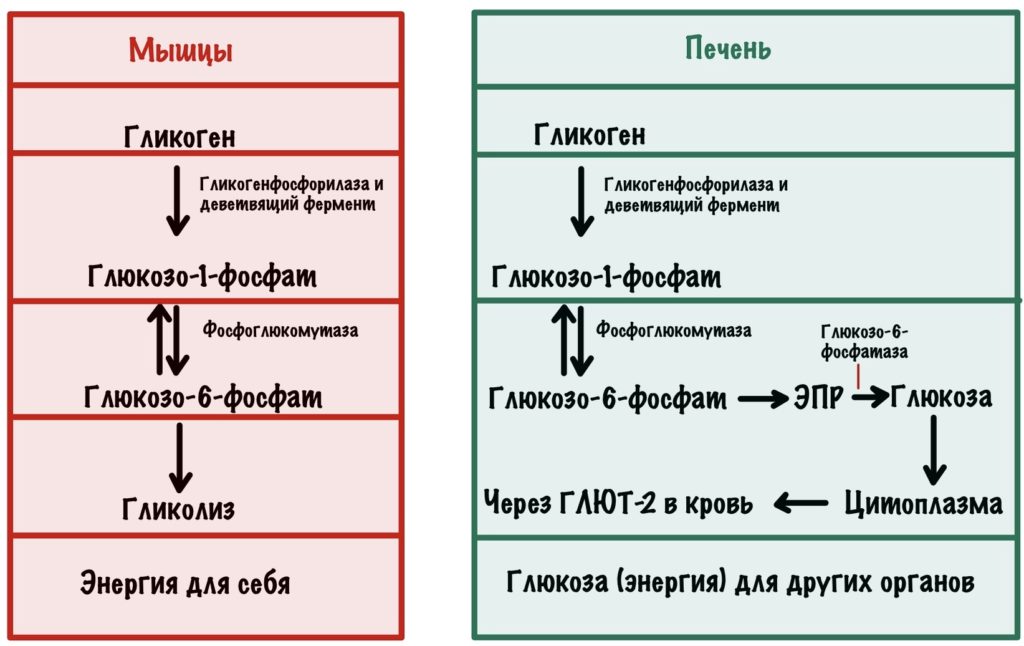
Дальше всё зависит от ткани и органа. Если это мышечная ткань, то глюкозо-6-фосфат идёт на гликолиз — мышцы получают энергию. С печенью всё немного сложнее.
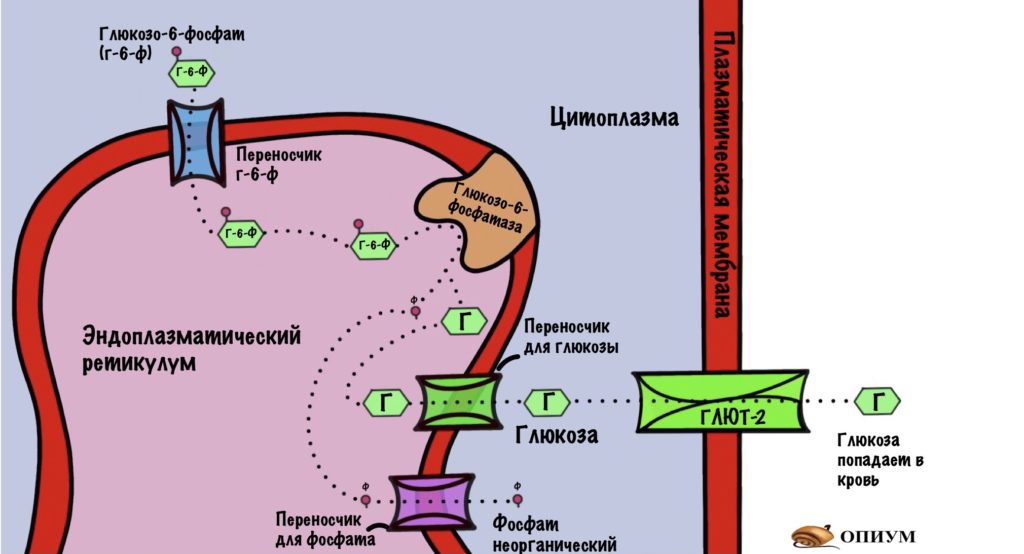
Глюкозо-6-фосфат находится в цитоплазме, и печени нужно протолкнуть его через плазматическую мембрану. Так печень отправит его в кровь, позаботившись о нашем мозге, других органах и тканях. Но вот незадача, в плазматической мембране нет переносчиков для глюкозо-6-фосфата, но есть для глюкозы.
Значит печени нужно получить свободную глюкозу. Но это не так просто. Глюкозо-6-фосфат находится в цитоплазме, а там же идёт гликолиз. Печень тоже получает энергию с помощью него. Если мы начнём превращать глюкозо-6-фосфат в глюкозу прямо в цитоплазме, то всё испортим. Весь глюкозо-6-фосфат будет превращаться в глюкозу и отправляться в кровь. Мы оставили печень без источника энергии. У неё есть и другие, но всё-таки гликолиз один из самых важных. Поэтому нужно разделить два этих процесса.
Сделаем это с помощью эндоплазматического ретикулума (ЭПР). Белки переносчики отправляют глюкозо-6-фосфат внутрь ЭПР. Там происходит дефосфорилирование глюкозы с помощью фермента — глюкозо-6-фосфатазы. Получаем глюкозу и неорганический фосфат, которые переносим из ЭПР в цитоплазму. Фосфат так и остаётся в цитоплазме, а глюкоза покидает клетку с помощью глюкозного транспортера второго типа (ГЛЮТ-2). Красиво?
Глюкозо-6-фосфатаза есть в печени, почках и тонком кишечнике. Клетки этих органов могут превратить глюкозу-6-фосфат в глюкозу — отправить её в кровь. В клетках других органов глюкоза попадает в ловушку, и ей из неё не выбраться.
Держите табличку по распаду гликогена для мышц и печени.
Синтез гликогена или гликогенез
Вот бы просто провести эти реакции в другую сторону и получить гликоген! Но так нельзя — эти процессы энергетически невыгодны, если вести их в другую сторону. Да и представьте какая путаница будет в клетке, если все субстраты и продукты одинаковые. Так что придётся разделить эти два процесса.
Мы знаем, что нужно получить в ходе синтеза. Гликоген. Но с чего начать? Вспоминаем, что когда глюкоза попадает в клетку, то она фосфорилируется с помощью гексокиназы или глюкокиназы. Под их действием мы получаем глюкозо-6-фосфат — это наша начальная молекула. Именно с неё мы начнём синтезировать гликоген.
Фосфат находится у шестого углерода, а мы будем образовывать альфа-1-4-гликозидную связь — нужно перенести фосфат к первому углероду. Этим занимается наш старый знакомый — фосфоглюкомутаза. Я ведь рисовал стрелочки в две стороны — это обратимая реакция. Так мы получаем глюкозо-1-фосфат.
Было бы удобно, если мы могли присоединить глюкозо-1-фосфат к другой глюкозе. А потом ещё к одной. И так нарастить цепь, получив гликоген. Но это сделать не получится — такой синтез энергетически не выгоден. Поэтому добавим ещё один этап для синтеза — этот этап должен увеличить энергетическую способность молекулы.
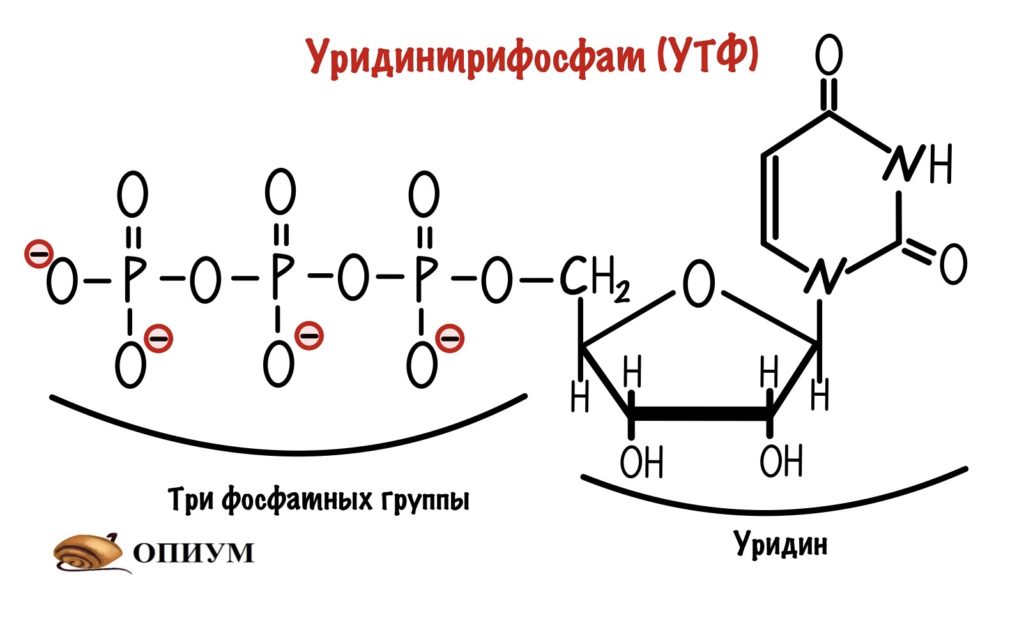
Наш организм делает это с помощью присоединения нуклеотида к молекуле глюкозо-1-фосфата. Этот нуклеотид — уридинтрифосфат (УТФ).
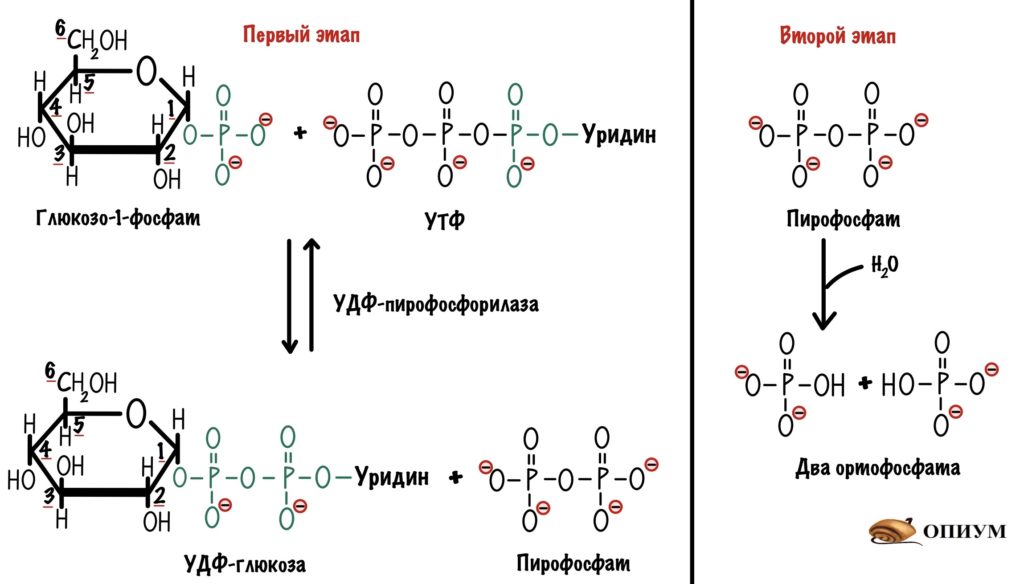
У него есть три фосфатных группы, а значит в нём неплохой запас энергии. Энергия эфирной связи двух фосфатных групп пойдет на присоединение глюкозо-1-фосфата к нуклеотиду. Эту реакцию катализирует УДФ-пирофосфорилаза. Протекает она в два этапа. На первом образуется УДФ-глюкоза и пирофосфат. На втором этапе идёт гидролиз пирофосфата — из него образуется два ортофосфата.
Из-за гидролиза пирофосфата общая реакция смещается в сторону образования УДФ-глюкозы. Потому что эта реакция практически необратима. Плюс через образование УДФ-глюкозы мы разделяем процессы синтеза и распада гликогена. Поэтому нам так важна эта реакция. Название у фермента странное, потому что он назван по обратной реакции.
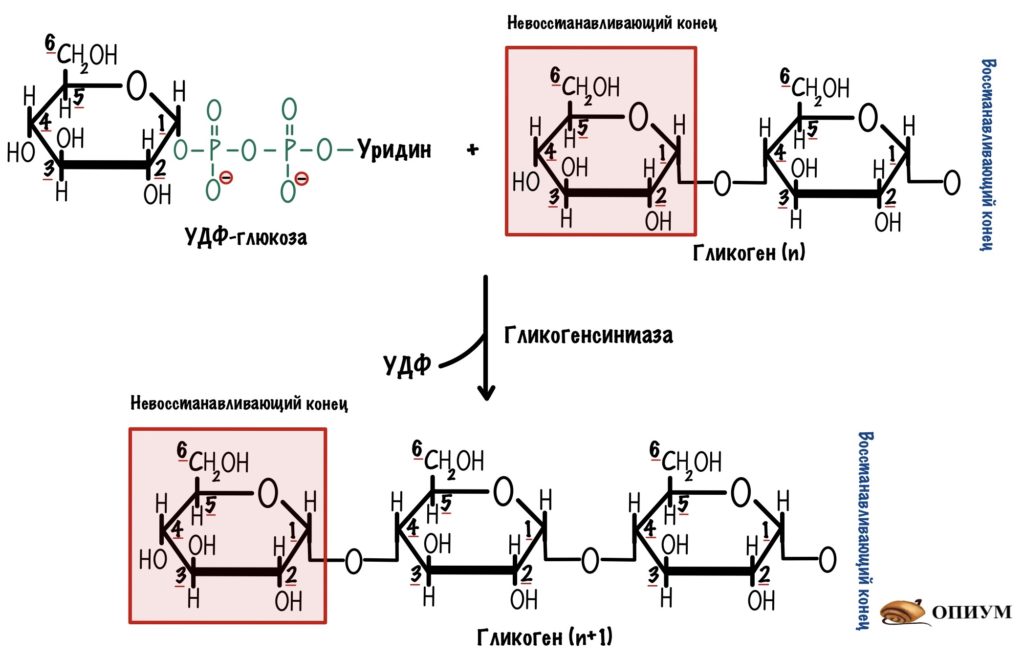
У УДФ-глюкозы большой запас свободной энергии. Мы сможем использовать её для нарастания цепи — образования альфа-1-4-гликозидной связи. А поможет нам в этом фермент — гликогенсинтаза. Она тоже действует с невосстанавливающего конца.
Почему она называется синтазой, а не синтетазой? Не синтетаза, потому что здесь используется энергия нашего нуклеотида — УДФ-глюкозы. А синтетазы используют энергию АТФ. В ходе этой реакции мы получаем УДФ и гликоген, в котором больше на одну молекулу глюкозы. УДФ потом фосфорилируется с помощью АТФ — снова образуется УТФ. УТФ вновь может использоваться для образования УДФ-глюкозы.
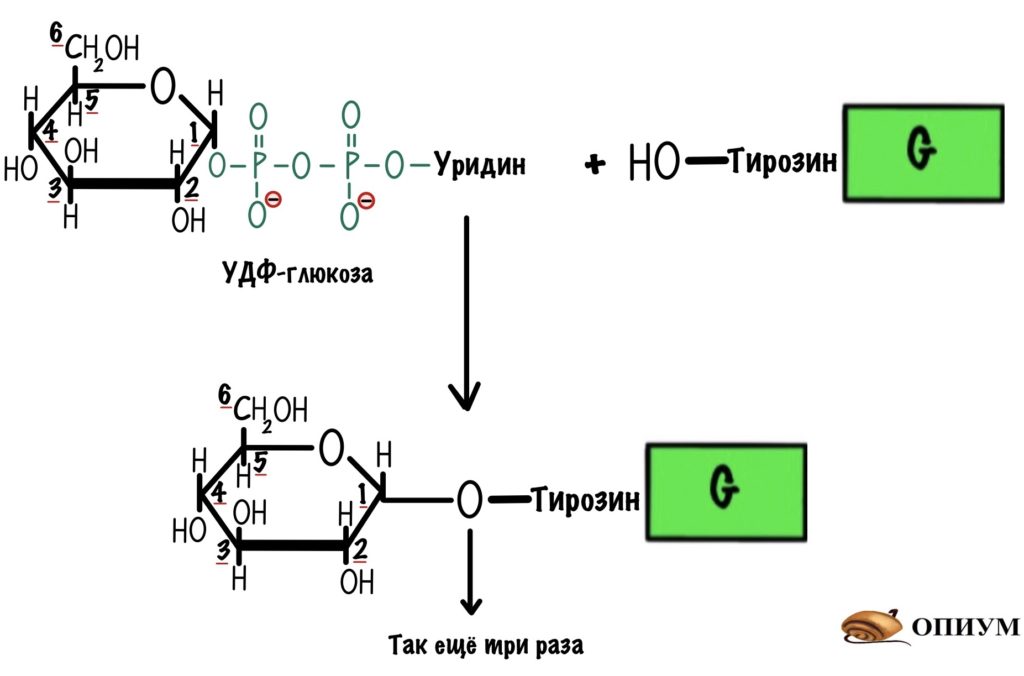
Гликогенсинтаза может присоединить молекулу УДФ-глюкозы только при наличии праймера. Праймер — это заготовка, которая используется для синтеза гликогена. Гликогенсинтаза может работать при условии, что в этой заготовке уже есть четыре молекулы глюкозы, но не меньше. Для синтеза праймера у нас есть специальный белок — гликогенин. Он присоединяет к себе четыре молекулы глюкозы из УДФ-глюкозы, а потом за дело берётся гликогенсинтаза. Присоединение идёт по тирозиновой группе гликогенина.

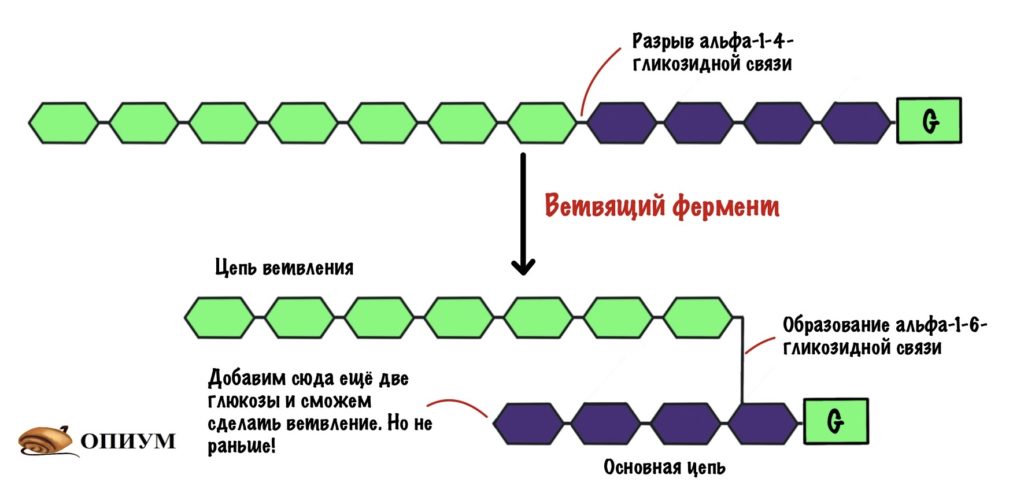
Как будем делать альфа-1-6-гликозидные связи? С помощью ветвящего фермента! У него тоже есть свои особенности:
- Работает при условии, что в цепи 11 и больше молекул глюкозы;
- Делает ветвление через четыре остатка от предыдущего. Но это минимум! Чаще через каждые десять остатков.
Ветвящий фермент разрывает альфа-1-4-гликозидную связь. А потом переносит участок цепи с образованием альфа-1-6-гликозидной связи — получаем новый участок ветвления.

Регуляция
С синтезом и распадом разобрались. Теперь будем учиться контролировать эту машину. Нам повезло, потому что придётся разобраться всего с двумя регуляторными ферментами.
Регуляторный фермент гликогенолиза — гликогенфосфорилаза .
Регуляторный фермент гликогенеза — гликогенсинтаза.
Контролируем распад гликогена
Будем учиться изменять активность гликогенфосфорилазы. Активность можно изменить с помощью фосфорилирования/дефосфорилирования и аллостерической регуляции.
У нас будут небольшие сложности, потому что строение гликогенфосфорилазы в печени и мышцах различно. Но они имеют одинаковую функцию — это изоферменты. Из-за этого у гликогенфосфорилаз есть отличия в аллостерической регуляции. Об этом поговорим ниже.
Фосфорилирование/дефосфорилирование для них одинаково, хоть его и могут вызывать разные сигнальные молекулы. А если точнее, то гормоны. Распад гликогена в мышцах вызывает адреналин. В печени — глюкагон и адреналин.
Адреналин действует в стрессовых ситуациях.
Глюкагон же действует между приёмами пищи — контролирует уровень глюкозы в крови. Когда глюкоза снижается, то уровень глюкагона растёт — это вызывает распад гликогена в печени. В общем он заботится, чтобы наш мозг не отключился из-за голода. Потому что мозг самая зависимая от глюкозы ткань. Наркоман!
Как гормоны и аллостерические регуляторы вызывают изменения активности гликогенфосфорилазы?
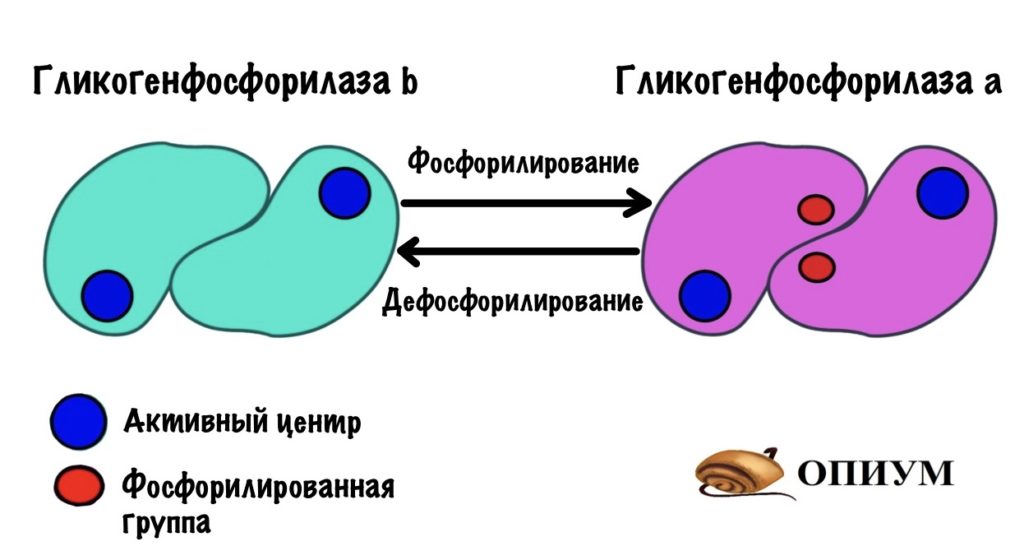
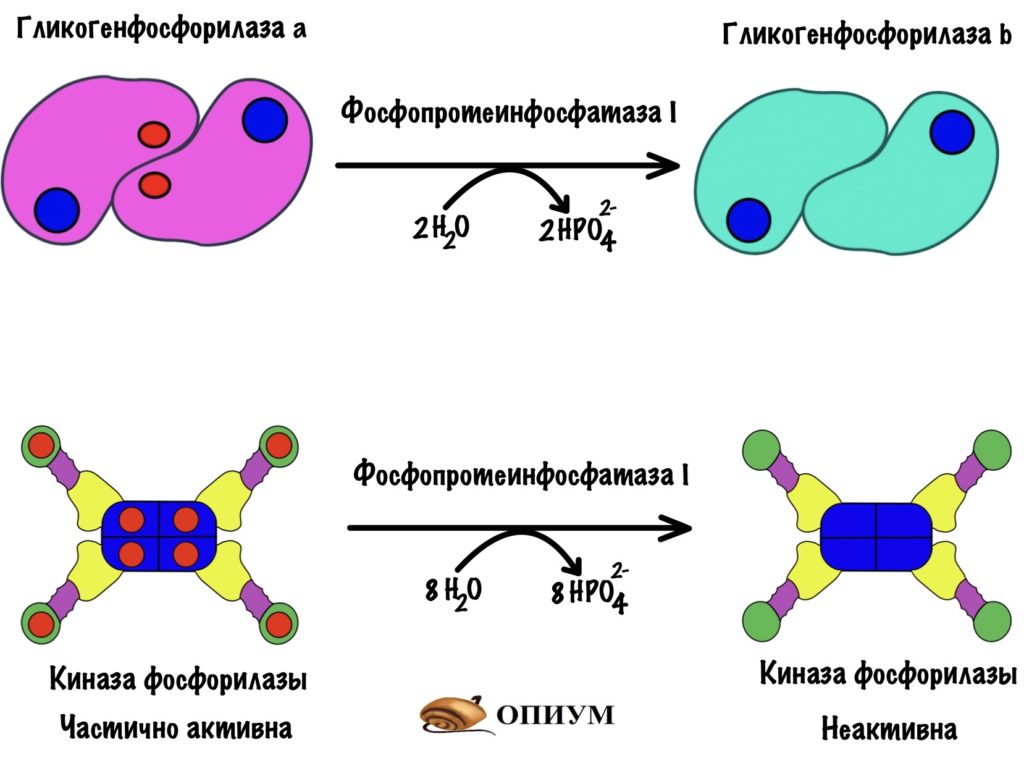
Для того, чтобы ответить на этот вопрос нужно познакомиться с ней поближе. У гликогенфосфорилазы четвертичная структура. Состоит из двух одинаковых субъединиц. Гликогенфосфорилаза существует в двух формах: гликогенфосфорилаза a и гликогенфосфорилаза b. Разница между ними в том, что гликогенфосфорилаза a фосфорилирована, а вот b — нет. Значит мы можем превратить гликогенфосфорилазу b в a через фосфорилирование. Или же гликогенфосфорилазу a в b путём дефосфорилирования.
Обе формы существуют в двух состояниях: R-relaxed и T-tense. Активность гликогенфосфорилаз выше в R-состоянии, чем в T. Между этими состояниями устанавливается константа равновесия. Для гликогенфосфорилазы a константа равновесия смещена в сторону R-состояния. Для гликогенфосфорилазы b константа равновесия смещена в сторону T-состояния. Гликогенфосфорилазы a и b активны только в R-состояниях! В T-состоянии у них частично закрыты активные центры. При этом гликогенфосфорилаза a активнее, чем гликогенфосфорилаза b. Сильно активнее.
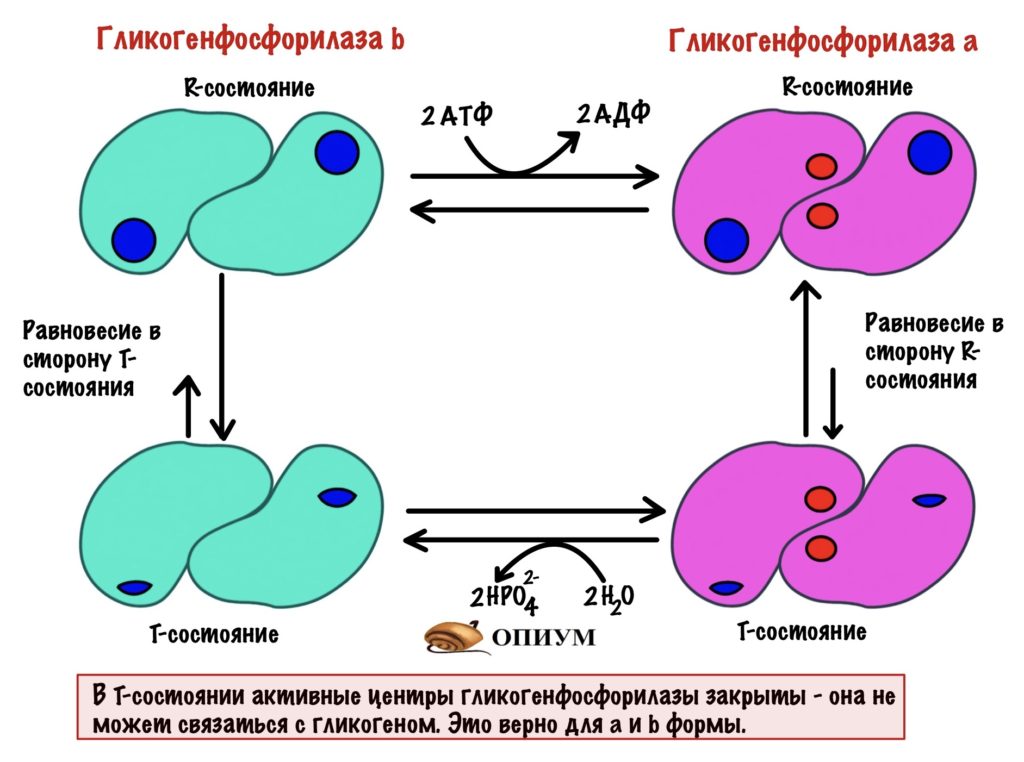

Пример 1. Мы недавно поели и лежим, отдыхаем. Уровень глюкозы в крови достаточный, а мышцам не нужно работать. При таких условиях большая часть гликогенфосфорилаз — это b формы. Константа смещена в сторону T-состояния — у неё нет активности. Получается, что мы не трогаем наши запасы гликогена.
Пример 2. Вышли на пробежку. Мышцам нужна энергия — они начинают разрушать гликоген. При таких условиях большая часть гликогенфосфорилаз мышц — это a формы. Константа смещена в сторону R-состоянии — у неё максимальная активность. Получается, что нас гликоген быстро разрушается до глюкозо-1-фосфата.
Пример 3. Сидим в универе уже пять часов. Завтракали часов семь назад. В крови снижается концентрация глюкозы — так дело не пойдет. При таких условиях большая часть гликогенфосфорилаз печени — это a формы. Константа смещена в сторону R-состояния, у неё максимальная активность. Получается, что нас гликоген быстро разрушается до глюкозо-1-фосфата.
Посмотрите ещё раз на картинку, которая была выше. Как можно активировать гликогенфосфорилазу? Фосфорилированием, конечно. Но есть что-то ещё? Да, есть. Можно сместить константу равновесия гликогенфосфорилазы b. Так мы переведём её в активное R-состояние.
Фосфорилируют гликогенфосфорилазу гормоны — адреналин и глюкагон. Но не самостоятельно, а через посредников. Дальше поймёте, про что я говорю.
Сложный путь со смещением константы равновесия выбирают аллостерические регуляторы. Регуляторы присоединяются к гликогенфосфорилазе b в T-состоянии и переводят её активное R-состояние.
Фосфорилирование
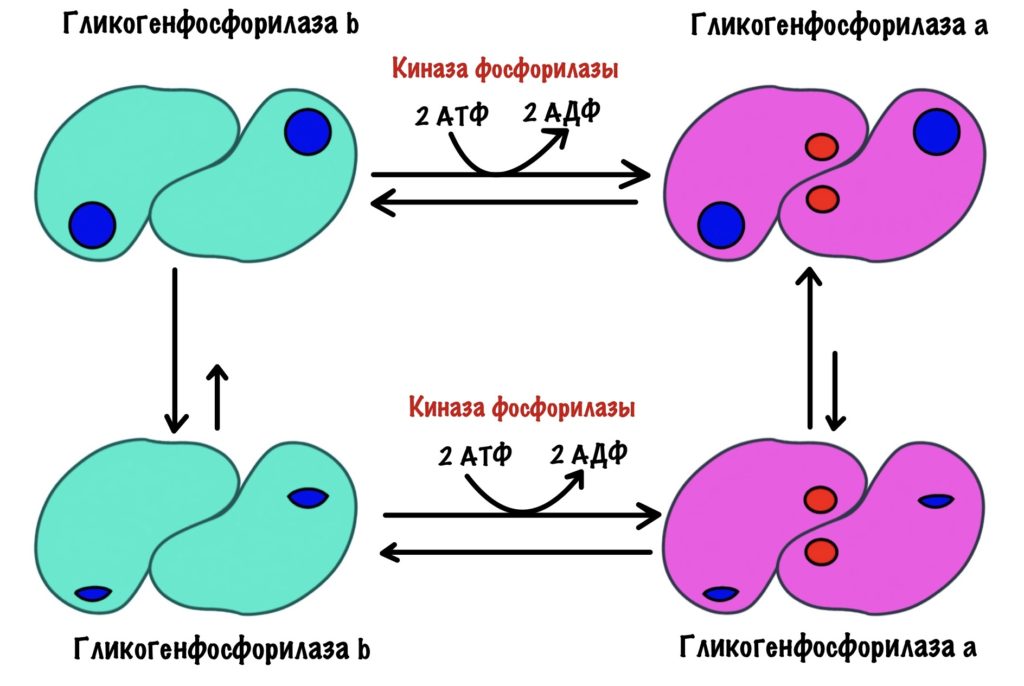
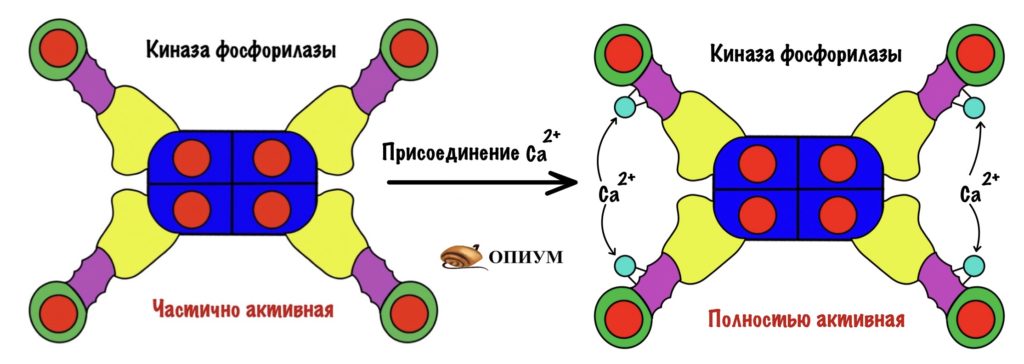
Будем разбираться с посредниками, через которые гормоны фосфорилируют гликогенфосфорилазу. Начнём снизу вверх: посмотрим на фермент, который этим занимается. И наш фермент — киназа фосфорилазы.
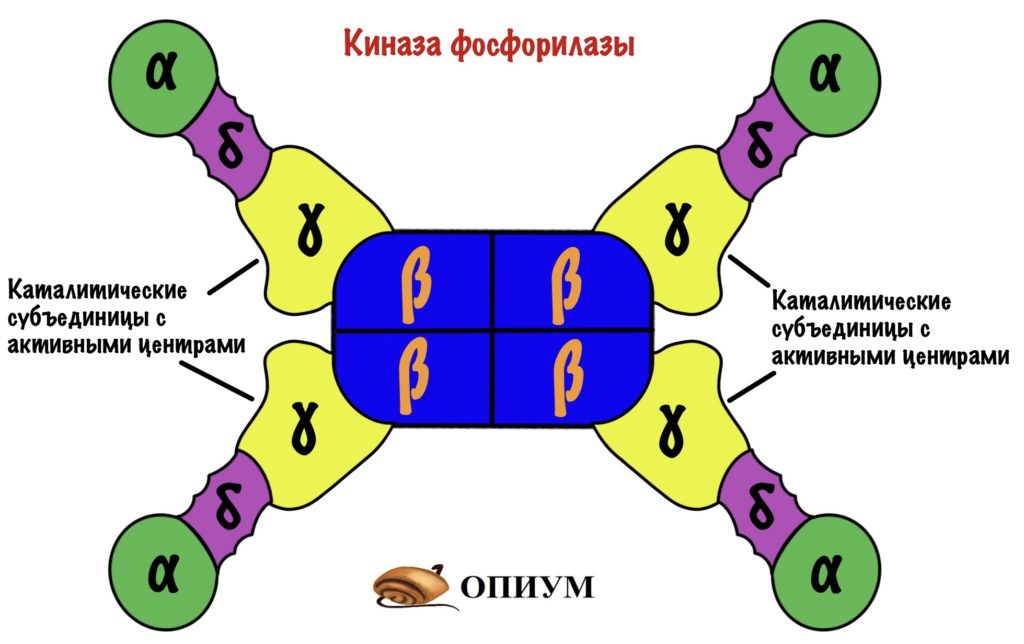
Киназа фосфорилазы имеет четвертичную структуру. В неё входит четыре типа субъединиц: альфа, бета, гамма и дельта. Каждой субъединицы по четыре штуки — получается, что всего их шестнадцать (!). Гамма-субъединицы фосфорилируют гликогенфосфорилазу — на них активные центры киназы. Остальные двенадцать нужны для регуляции этого фермента.
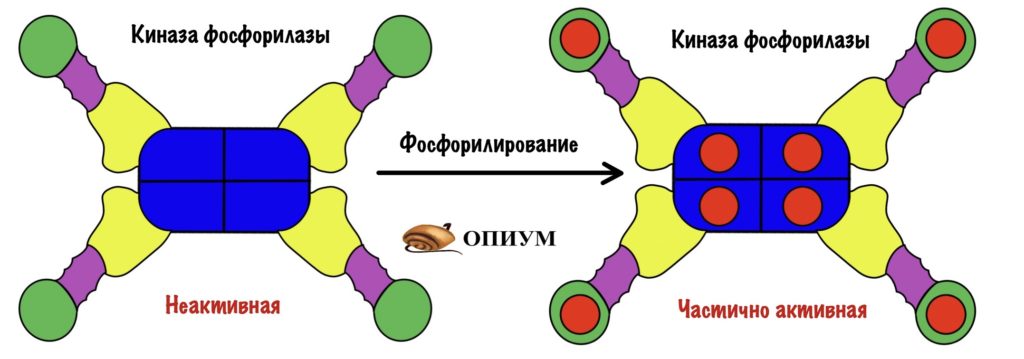
На рисунке неактивная форма киназы фосфорилазы. Мы активируем её в несколько этапов. Сначала нужно фосфорилировать альфа и бета-субъединицы. Так мы получаем частично активную киназу фосфорилазы.
Раз это только частичная активность, то можно дальше активировать её. Для того, чтобы выкрутить эффективность киназы фосфорилазы на максимум нужно присоединить к ней кальций. За его связывание ответственны дельта-субъединицы — у них такое же строение, как у кальмодулина.
Мы получили полностью активную киназу фосфорилазы, которая переведёт кучу гликоненфосфорилаз b в a.
И ещё одно: можно получить частично активную киназу через присоединение кальция — пока она не фосфорилирована. Но для полной активности нужно фосфорилирование и кальций!
С активацией гликогенфосфорилазы понятно — этим занимается киназа фосфорилазы. Она же активируется с помощью фосфорилирования и присоединения ионов кальция. Теперь пойдём выше:
Что активирует киназу фосфорилазы?
Ответить сложно, потому что в мышцах и печени разные способы её активации. Нужно разобраться с каждым отдельно.
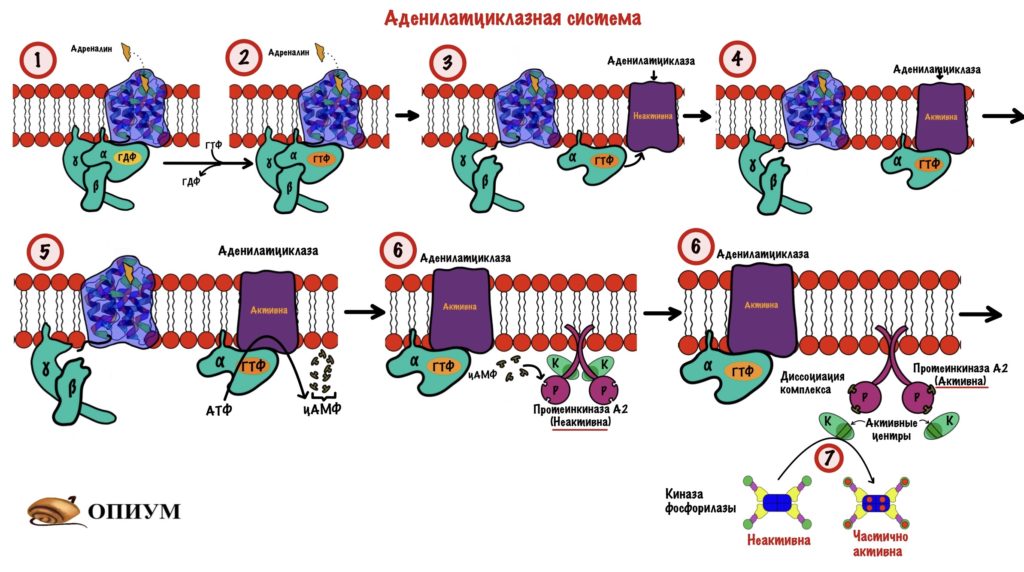
Мышцы. Здесь нужно вспомнить аденилатциклазную систему — советую перечитать всю статью по сигнальным молекулам, если не очень хорошо их помните. Представим, что я бегу от злой собаки. В такой ситуации мозговое вещество надпочечников увеличивает выброс адреналина в кровь.
- Адреналин связывается с бета-2-адренорецепторами скелетных мышц. Это вызывает конформационные изменения в рецепторе, а затем и G-белке.
- В G-белке происходит замена ГДФ на ГТФ.
- Это приводит к диссоциации комплекса субъединиц: альфа-субъединица соединена с ГТФ, а бета с гаммой. Альфа-субъединица в комплексе с ГТФ перемещается в пределах клеточной мембраны пока не наткнётся на аденилатциклазу.
- Когда комплекс альфа-субъединицы с ГТФ присоединяется к аденилатциклазе, тогда она активируется.
- Начинается синтез цАМФ из АТФ (цАМФ — это вторичный мессенджер).
- ЦАМФ активирует протеинкиназу А2 — через диссоциацию комплекса.
- Протеинкиназа А2 фосфорилирует субъединицы киназы фосфорилазы — это её частичная активация.
В мышцах идёт мышечное сокращение, а для этого нужен кальций. Часть кальция соединяется с дельта субъединицами киназы фосфорилазы — она становится полностью активной. А дальше вы уже знаете: киназа фосфорилазы переводит гликогенфосфорилазу b в a.
Печень. На неё может действовать адреналин и глюкагон. Адреналин действует в критических ситуациях, а глюкагон между приёмами пищи. Но оба гормона приводят к одному и тому же — активации аденилатциклазной системы. То есть к частичной активации киназы фосфорилазы. В мышцах она соединяется с кальцием, а в печени? В печени тоже, но не всегда.
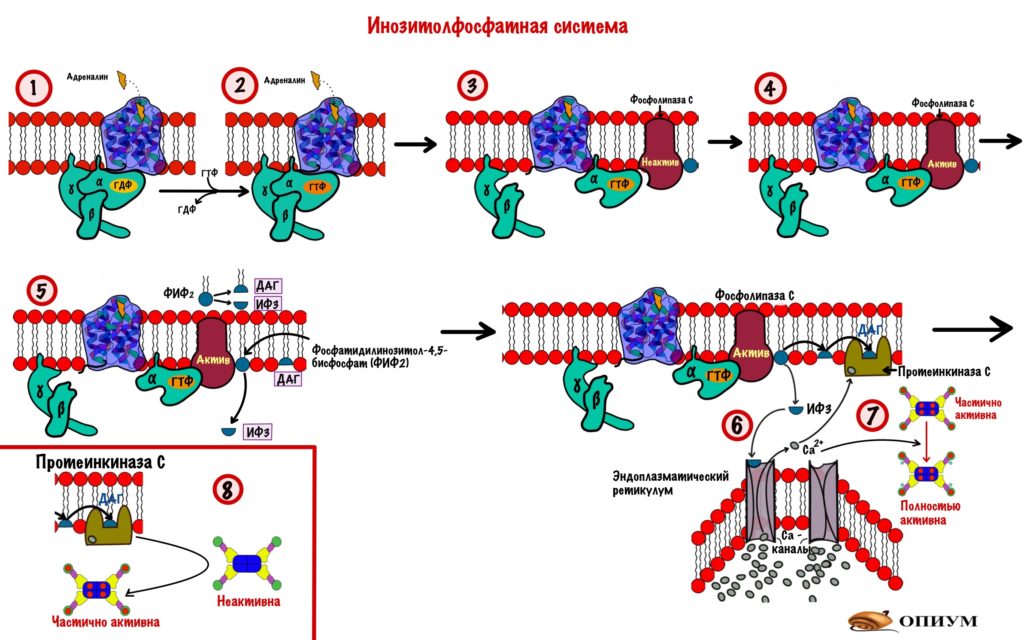
В печени есть рецепторы к адреналину, но не только бета-2 — они запускают аденилатциклазную систему. Есть ещё и альфа-1. Действие адреналина через альфа-1-адренорецепторы другое — он активирует инозитолфосфатную систему.
- Адреналин связывается с альфа-1-адренорецептором. Это вызывает конформационные изменения в рецепторе, а затем и G-белке.
- В G-белке происходит замена ГДФ на ГТФ.
- Это приводит к диссоциации комплекса субъединиц: альфа-субъединица соединена с ГТФ, а бета с гаммой. Альфа-субъединица в комплексе с ГТФ перемещается в пределах клеточной мембраны пока не наткнётся на фосфолипазу C.
- Активация фосфолипазы C через её соединение с комплексом альфа-субъединицы и ГТФ.
- Фосфолипаза C гидролизует фосфатидилинозитол-4,5-бисфосфат (ФИФ2). Образуется два вторичных мессенджера: диацилглицерол (ДАГ) и инозитол-1,4,5-трифосфат (ИФ3).
- ИФ3 — это полярная молекула, которая может путешествовать по цитоплазме. Она натыкается на кальциевые каналы эндоплазматического ретикулума и открывает их.
- ДАГ и кальций активируют протеинкиназу C. Кальций связывается с киназой фосфорилазы и полностью активирует её.
- Протеинкиназа C фосфорилирует киназу фосфорилазы и приводит к её частичной активации.
Инозитолфосфатная система увеличивает концентрацию кальция в цитоплазме. Кальций соединяется с киназой фосфорилазы, которая была фосфорилирована аденилатциклазной системой.
Инозитолфосфатная система самостоятельно фосфорилирует киназу фосфорилазы — частичная активация. Потом доводит её активность до максимума через присоединение кальция.
В критической ситуации на печень действует адреналин — кальций попадает в цитоплазму. Но между приёмами пищи действует глюкагон, он активирует аденилатциклазную систему. Частично активирует киназу фосфорилазы, но этого хватает! Необязательно доводить её эффективность до максимума — работает, ну и хорошо!
На мышцы тоже не всегда действует адреналин. Там киназа фосфорилазы частично активируется через соединение с кальцием. Есть там и ещё одна фишечка, но об этом позже.
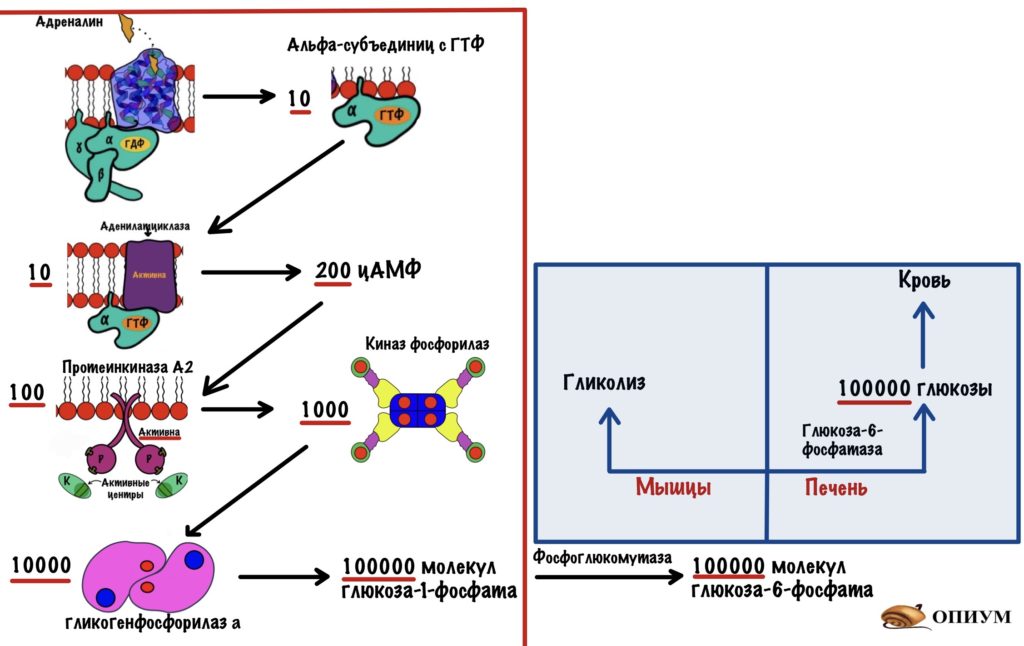
Зачем столько этапов в активации?
Дело в том, что на каждом этапе происходит амплификация сигнала — его усиление. Один гормон связывается с одним рецептором, но при этом активирует десять G-белков. Десять G-белков активируют десять аденилатциклаз, но они синтезируют не десять молекул цАМФ, а двести. Двести молекул цАМФ активируют сто протеинкиназ А2, которые фосфорилируют тысячу киназ фосфорилаз. Эта тысяча киназ фосфорилаз переведёт десять тысяч гликогенфосфорилаз b в a. Десять тысяч гликогенфосфорилаз a смогут высвободить сто тысяч молекул глюкозо-1-фосфата. Фосфоглюкомутаза переведёт его в глюкозо-6-фосфат.
Далее всё зависит от ткани. В мышцах глюкозо-6-фосфат отправится в топку — гликолиз. А в печени произойдёт его дефосфорилирование — образуется глюкоза, которая отправится в кровь.
Аллостерическая регуляция
Осталось последнее — аллостерическая регуляция гликогенфосфорилазы. Она различна в мышцах и печени.
Мышцы
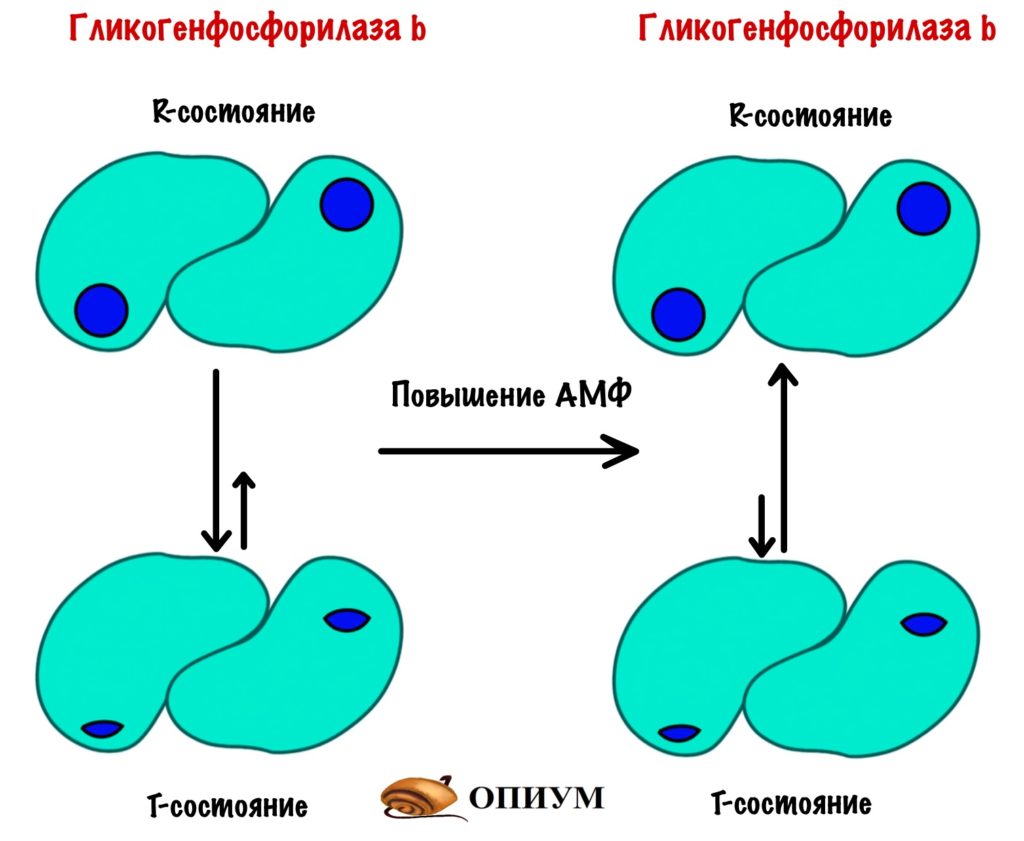
Представим, что мы работаем физически. Наши мышцы в качестве энергии используют АТФ. При её разрушении образуется АМФ. АМФ это аллостерический регулятор. Он действует на гликогенфосфорилазу b и смещает константу равновесия в сторону R-состояния. Так гликогенфосфорилаза b становится активной.

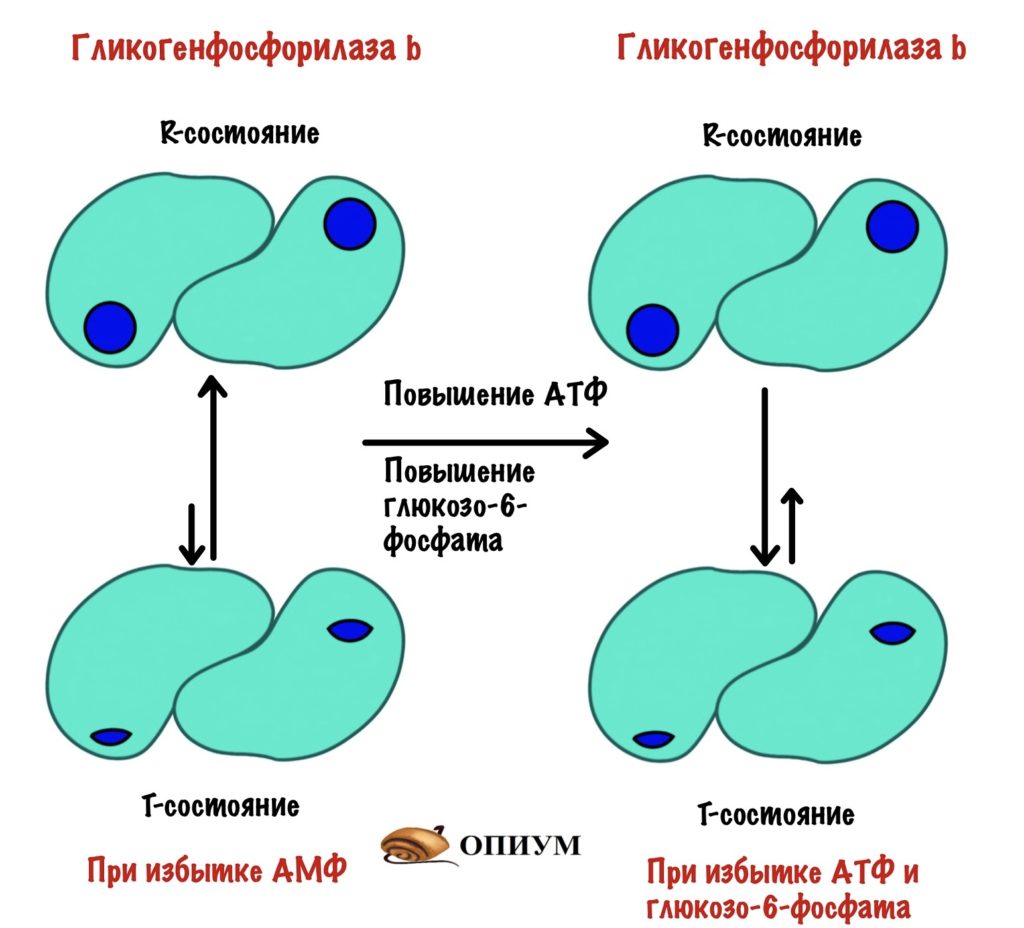
Если же мышцы отдыхают, то уровень АТФ и глюкозо-6-фосфата большой. Они связываются с аллостерическими центрами гликогенфосфорилазы b — смещают константу равновесия в сторону T-состояния.

Печень
В печени у гликогенфосфорилазы немного другое строение. Гикогенфосфорилаза b не имеет аллостерических центров для АМФ. Но у гликогенфосфорилазы a есть аллостерические центры для глюкозы.
После приёма пищи концентрация глюкозы в крови растёт — она попадает в печень. Там она связывается с аллостерическим центром гликогенфосфорилазы а — смещает константу равновесия в сторону T-состояния. При этом состоянии гликогенфосфорилаза a неактивна.
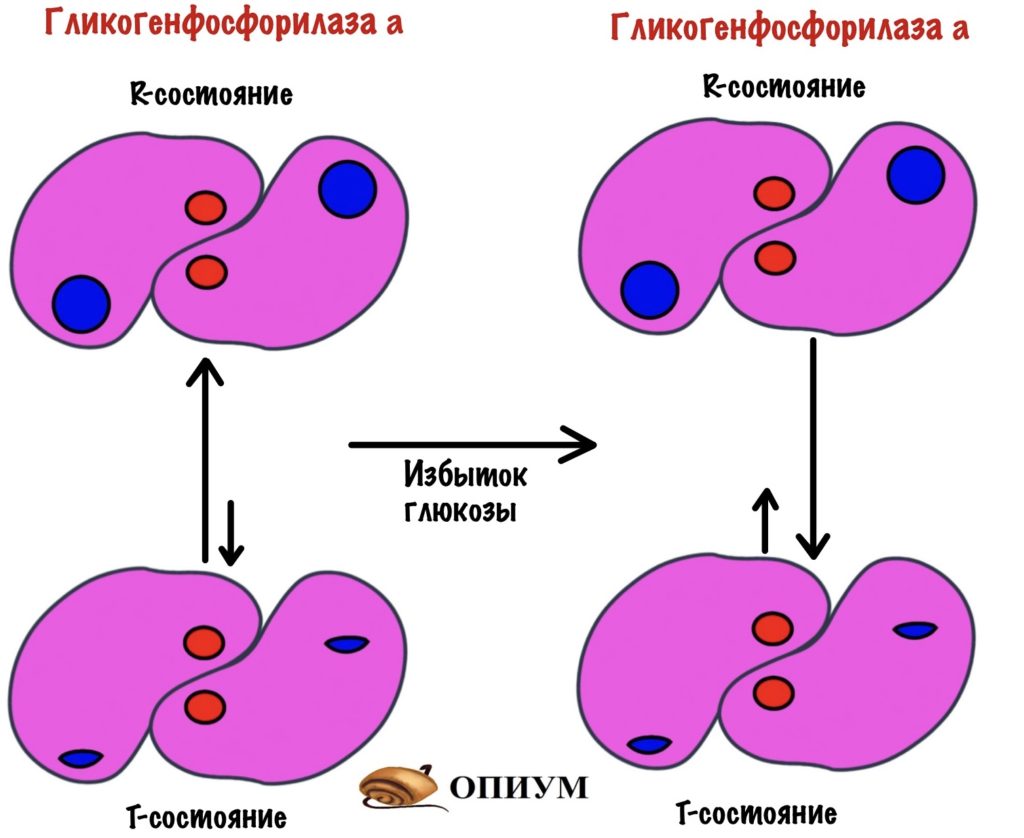

Когда уровень глюкозы в крови падает, то она отщепляется от аллостерического центра. Гликогенфосфорилаза a переходит в R-состояние, а значит становится активной.
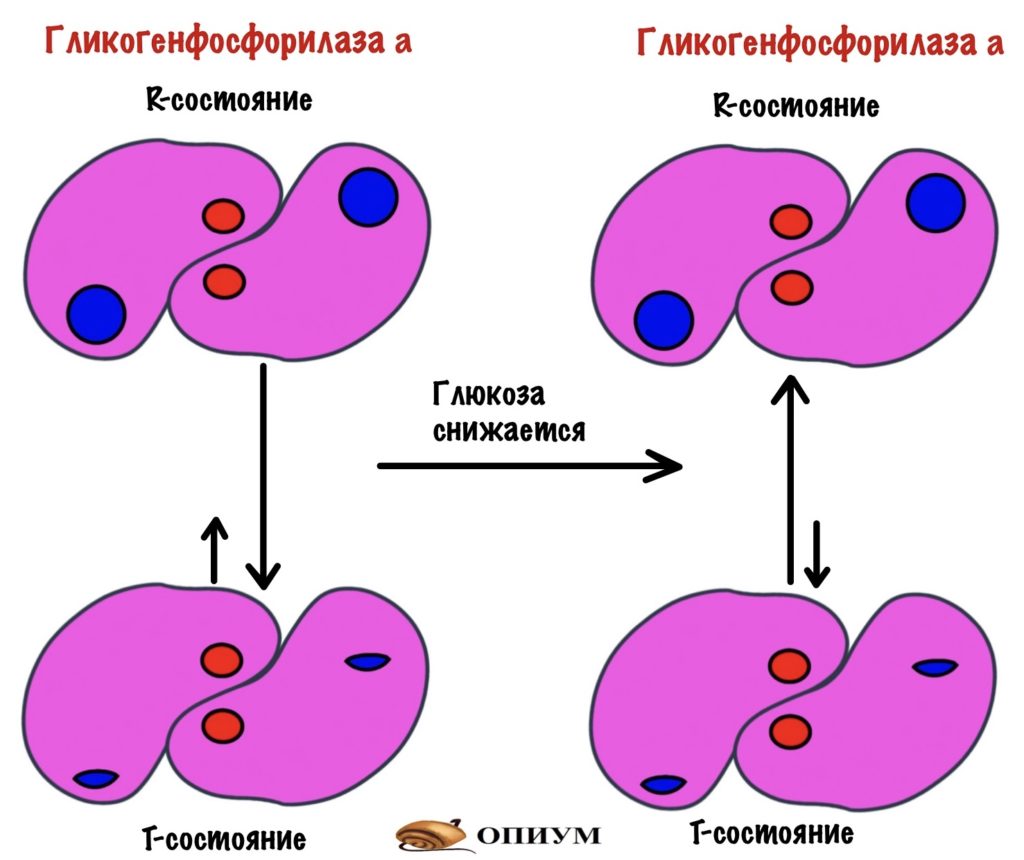

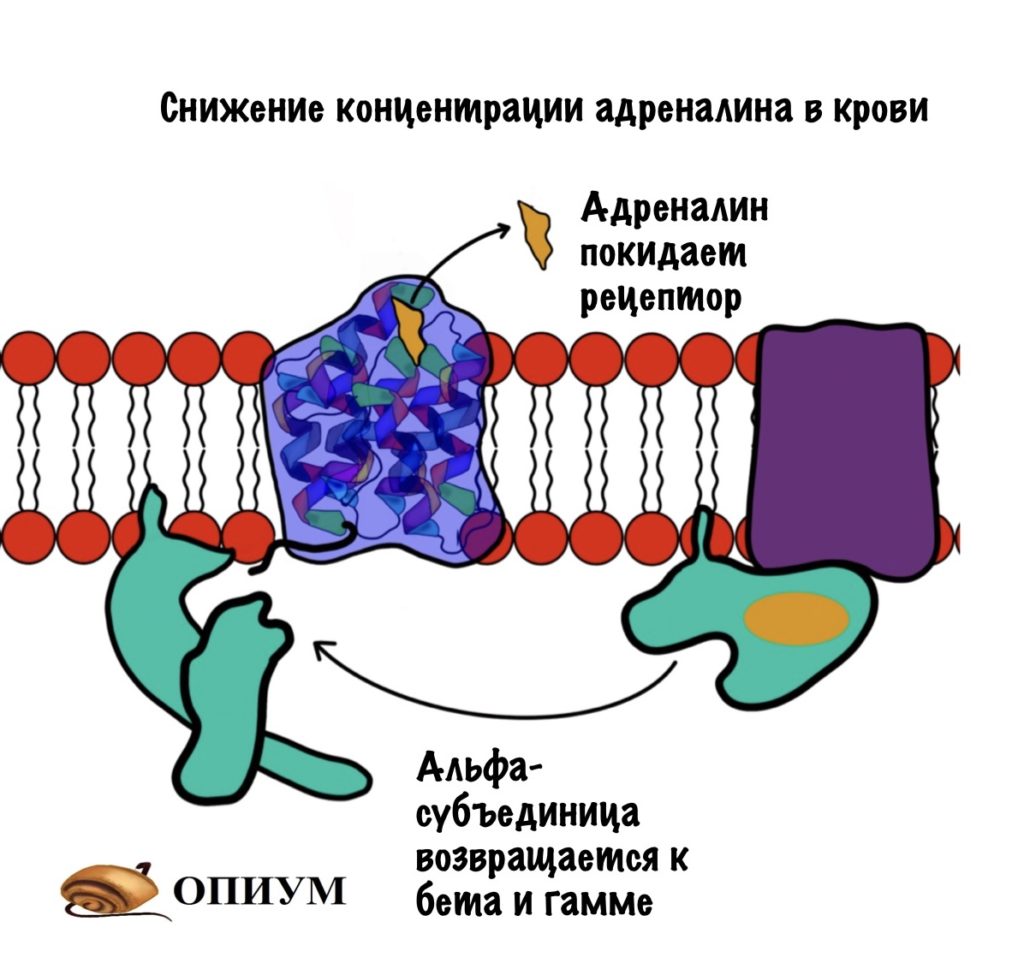
Как отключить гликогенфосфорилазу и оставить гликоген в покое?
Снизить концентрацию гормона в крови. Он перестанет присоединяться к рецептору, что остановит аденилатциклазную и инозитолфосфатную систему.
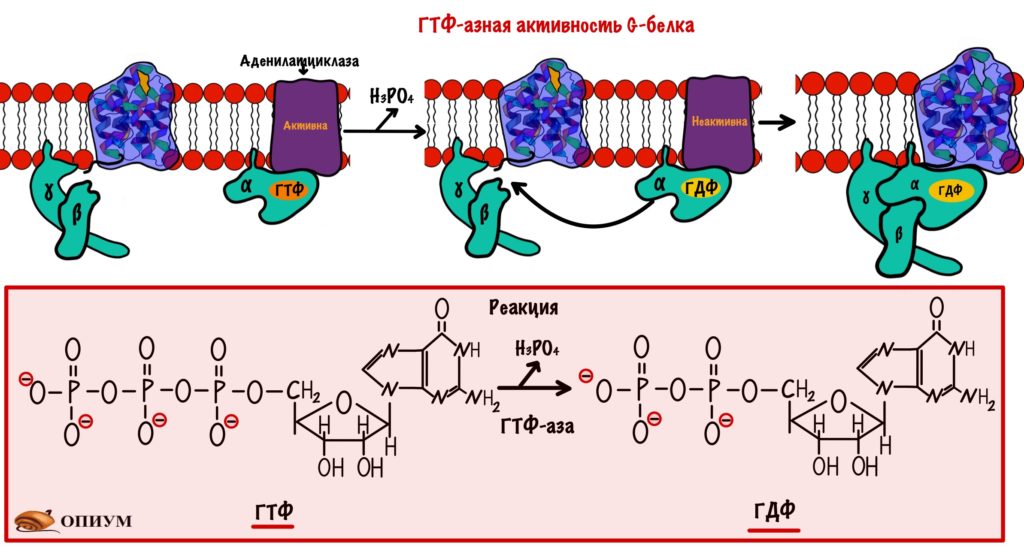
G-белки имеют ГТФ-азную активность. Они переводят ГТФ в ГДФ, комплекс альфа-субъединицы и ГДФ перестаёт активировать аденилатциклазу, у него увеличивается сродство к бета и гамме-субъединицам.
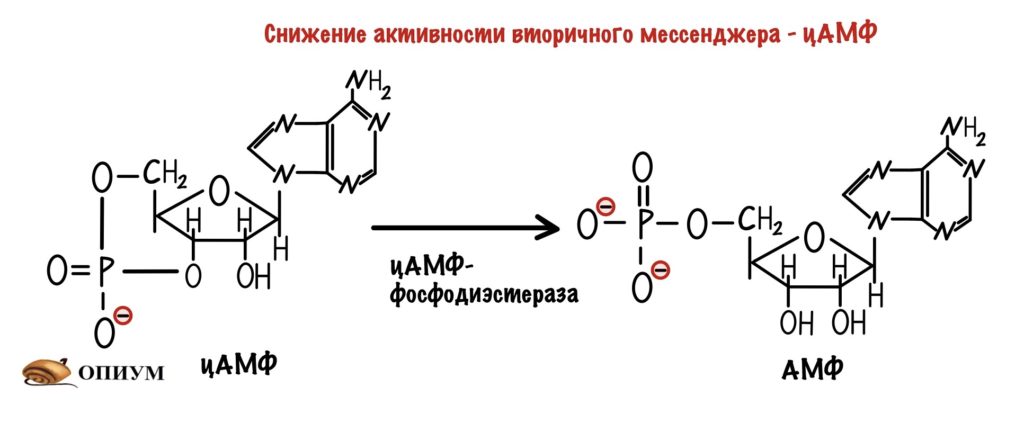
Разрушение вторичного мессенджера — цАМФ. Для этого есть фермент — фосфодиэстераза, она превращает цАМФ в АМФ. У АМФ меньше активность, чем у цАМФ. Ещё АМФ переводит гликогенфосфорилазу b в активное R-состояние…

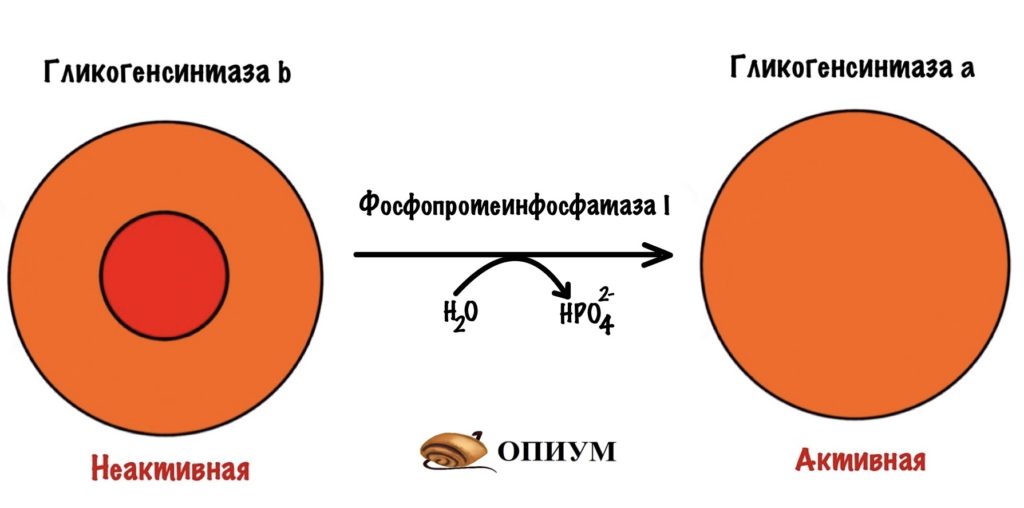
Фосфопротеинфосфатаза I — дефосфорилирует ферменты: киназу фосфорилазы и гликогенфосфорилазу. Переводит их в неактивное состояние — контролирует ключевые ферменты распада гликогена. Фосфопротеинфосфатаза I ещё понадобится нам, запомните её.
Контролируем синтез гликогена
Регуляция через гликогенсинтазу. Её активность можно изменять с помощью аллостерической регуляции и фосфорилирования/дефосфорилирования.
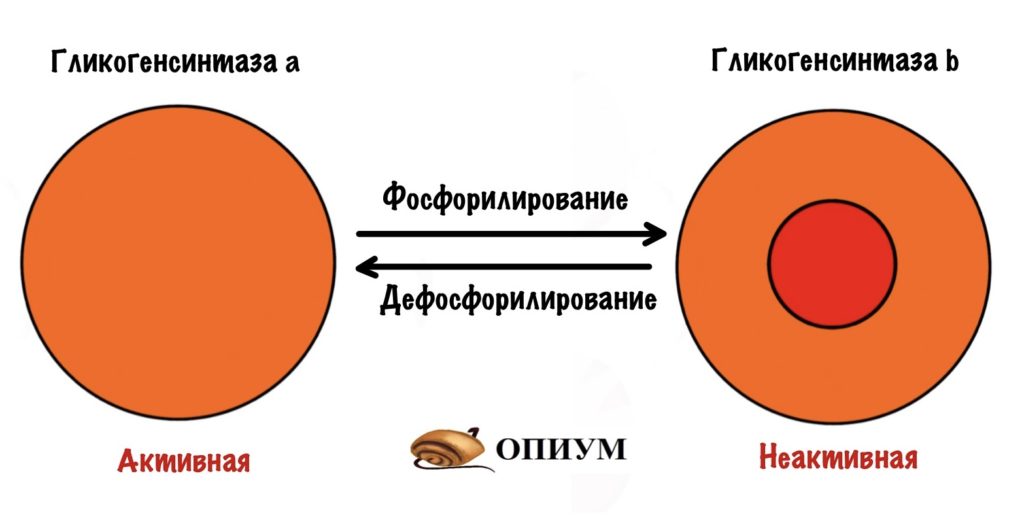
Гликогенсинтаза тоже может быть в a и b форме, но есть отличие от гликогенфосфорилазы. У гликогенсинтазы a нет фосфорной группы, а у b есть. Гликогенсинтаза активна в дефосфорилированной форме! Получается, что гликогенсинтаза a активна, а гликогенсинтаза b неактивна.
Регуляции гликогенсинтазы и гликогенфосфорилазы похожи. Только для активации гликогенсинтазы нужно провести дефосфорилирование. Этим занимается инсулин, так что она тоже под гормональным контролем.
Дефосфорилирование
Дефосфорилирует гликогенсинтазу фосфопротеинфосфатаза I. Мы уже встречались с этим ферментом, а чуть позже поговорим про него подробнее. Пока нужно запомнить, что она активируется инсулином — действует после того, как мы покушали.
Но почему гликогенсинтаза находилась в неактивной b форме? Смотрите, кушаем мы пару раз в день. Пиковые концентрации инсулина в крови будут после приёма пищи. Тогда будет активироваться гликогенсинтаза — синтезируем гликоген. Но в остальное время нам не нужно, чтобы гликогенсинтаза работала.
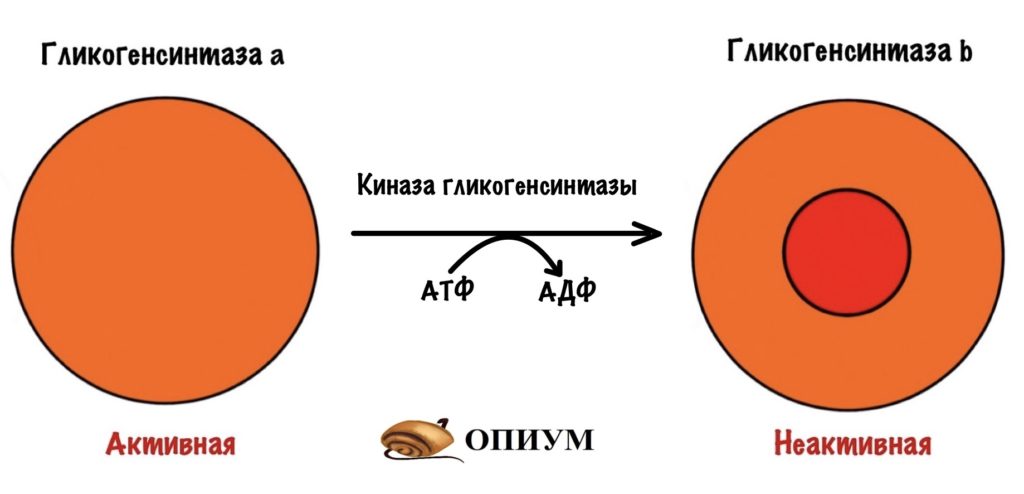
Поэтому гликогенсинтаза a фосфорилируется с помощью киназы глигогенсинтазы, когда нам не нужно запасать гликоген — между приёмами пищи.
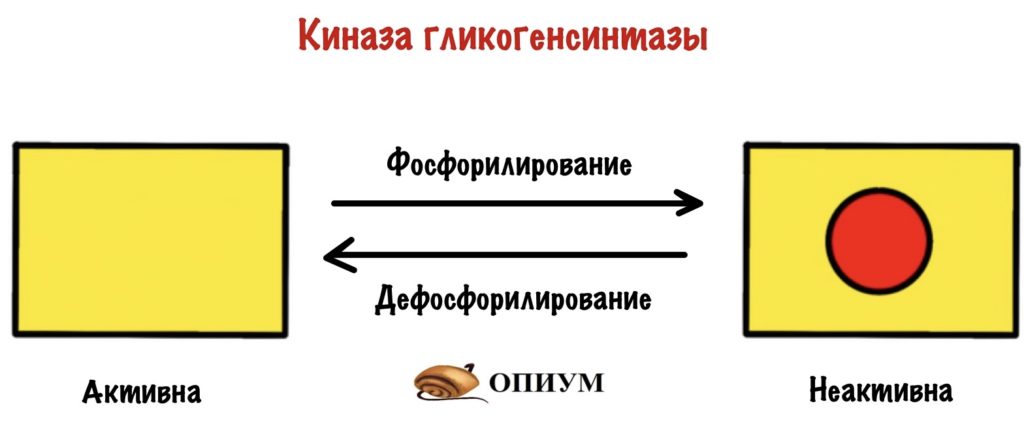
Киназа гликогенсинтазы тоже активна в дефосфорилированной форме, но неактивна в фосфорилированной.
Инсулин фосфорилирует киназу гликогенсинтазы. Не самостоятельно конечно, а через свой рецептор. Действие инсулина приводит к активации протеинкиназы B, которая фосфорилирует киназу гликогенсинтазы и переводит её в неактивное состояние. Киназа гликогенсинтазы перестаёт фосфорилировать гликогенсинтазу. Она перестаёт выключать её.
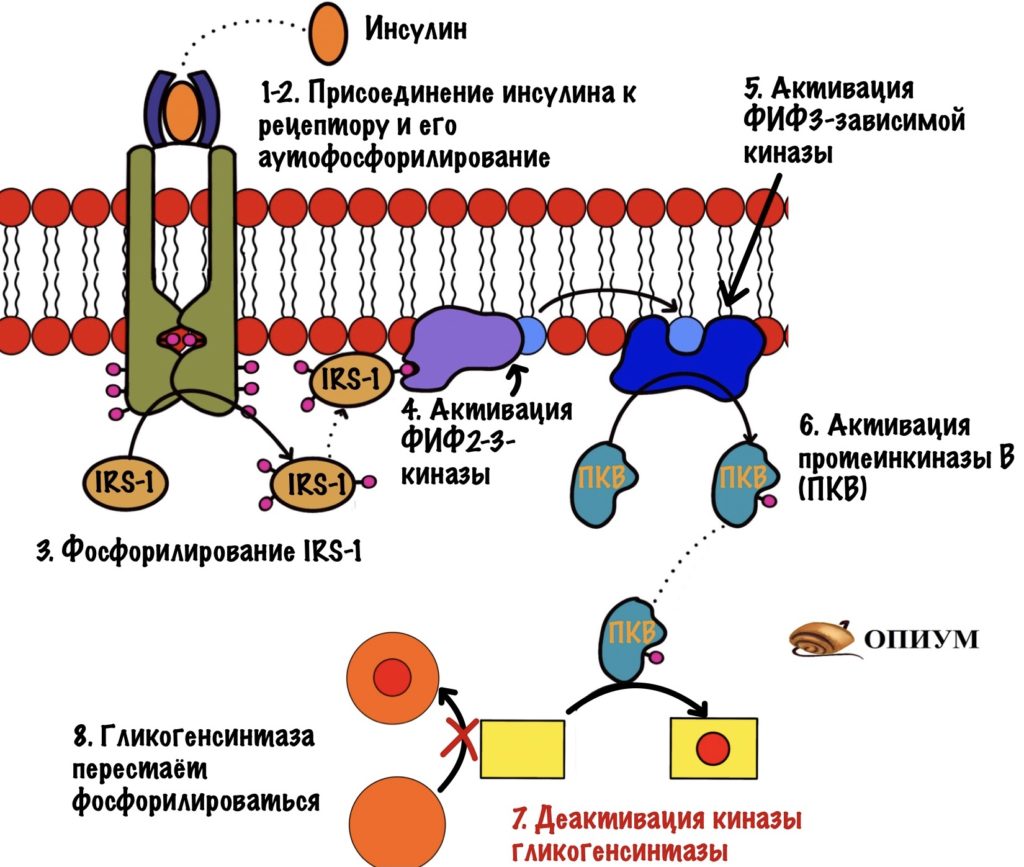

Гликогенсинтазы, которые были фосфорилированы киназой, попадают в лапы фосфопротеинфосфатазы I. Она дефосфорилирует их, переводя в активные формы.
Аллостерическая регуляция
Гликогенсинтазу b можно активировать с помощью аллостерической регуляции — для этого нужен глюкозо-6-фосфат или глюкоза. Поэтому после приёма пищи, когда концентрация глюкозы-6-фосфата большая, он присоединяется к аллостерическому центру гликогенсинтазы b. Организм не любит что-то терять, особенно если это можно запасти.
Фосфопротеинфосфатаза I и другие ключевые ферменты
Вы заметили, что фосфопротеинфосфатаза I занимается дефосфорилированием ключевых ферментов: киназы фосфорилазы, гликогенфосфорилазы и гликогенсинтазы. Она отключает два первых фермента и включает последний. Через фосфопротеинфосфатазу I объединяется синтез и распад гликогена.
Все эти ферменты: киназа фосфорилазы, гликогенфосфорилаза, гликогенсинтаза и фосфопротеинфосфатаза I находятся в грануле гликогена. Они связаны друг с другом с помощью белка — гликоген таргетингового протеина GM. Если вы думаете, что он только связывает, то это не так. У GM есть два участка для фосфорилирования.
Первый участок для инсулина — он активирует киназы, одна из которых фосфорилирует GM. Фосфорилирование GM по этому участку активирует фосфопротеинфосфатазу I. Она активирует гликогенсинтазу, но отключает киназу фосфорилазы и гликогенфосфорилазу. Запуск синтеза гликогена.
Второй участок в мышцах для адреналина. В печени же для адреналина и глюкагона. Они включают аденилатциклазную систему — активируют протеинкиназу А2. Протеинкиназа А2 фосфорилирует GM во втором участке — цепляет две фосфатные группы. Это приводит к тому, что от GM отщепляется фосфопротеинфосфатаза I. Её активность снижается — она больше не находится рядом с ключевыми ферментами. Ещё протеинкиназа А2 фосфорилирует ингибитор ФПФ I — активирует его. Ингибитор соединяется с ФПФ I и отключает её. Запуск распада гликогена.
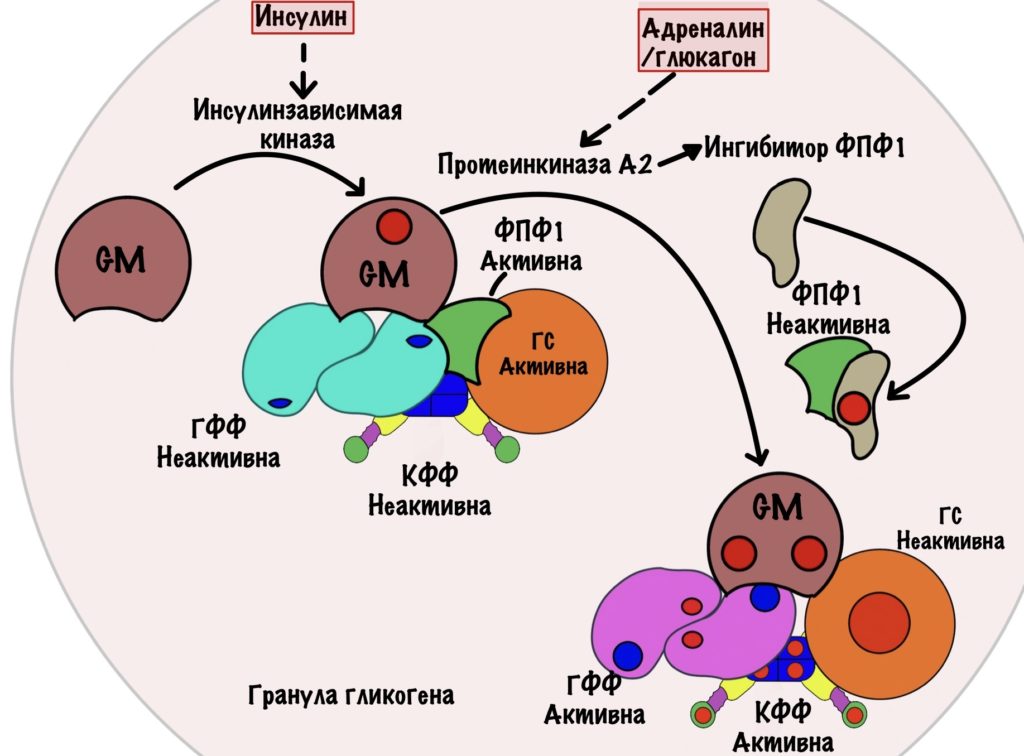

Посмотрим глобальнее
Мы рассмотрели всё отдельно — время собрать общую картинку. Нужно понять, что синтез и распад гликогена похожи на выключатель. Ты можешь включить свет или выключить его, но не можешь включить и выключить одновременно. Также и в нашем организме. Если мы запускаем синтез гликогена, то распад должен быть отключён. А если запускаем распад, то нужно отключить синтез. Такая регуляция называется реципрокной.
Посмотрим, что происходит в нашей тушке на трёх разных ситуациях: между приёмами пищи, в стрессовой ситуации (физическая нагрузка или что-то ещё) и после еды.
Между приёмами пищи
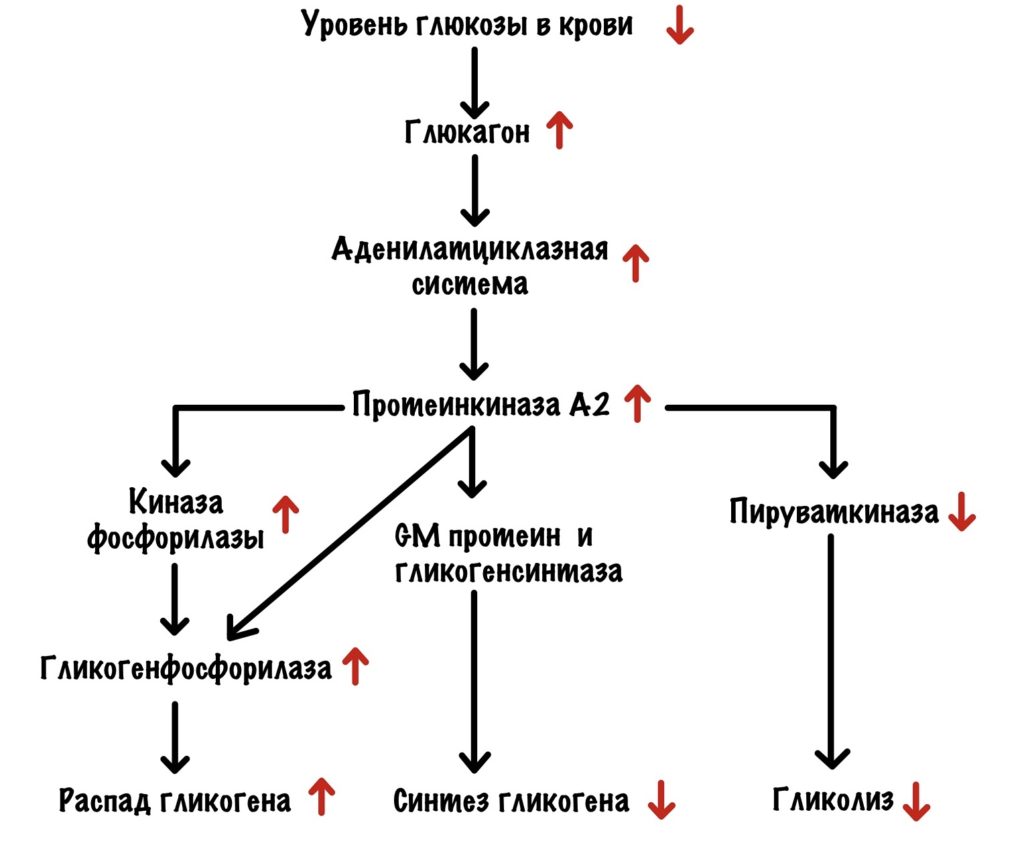
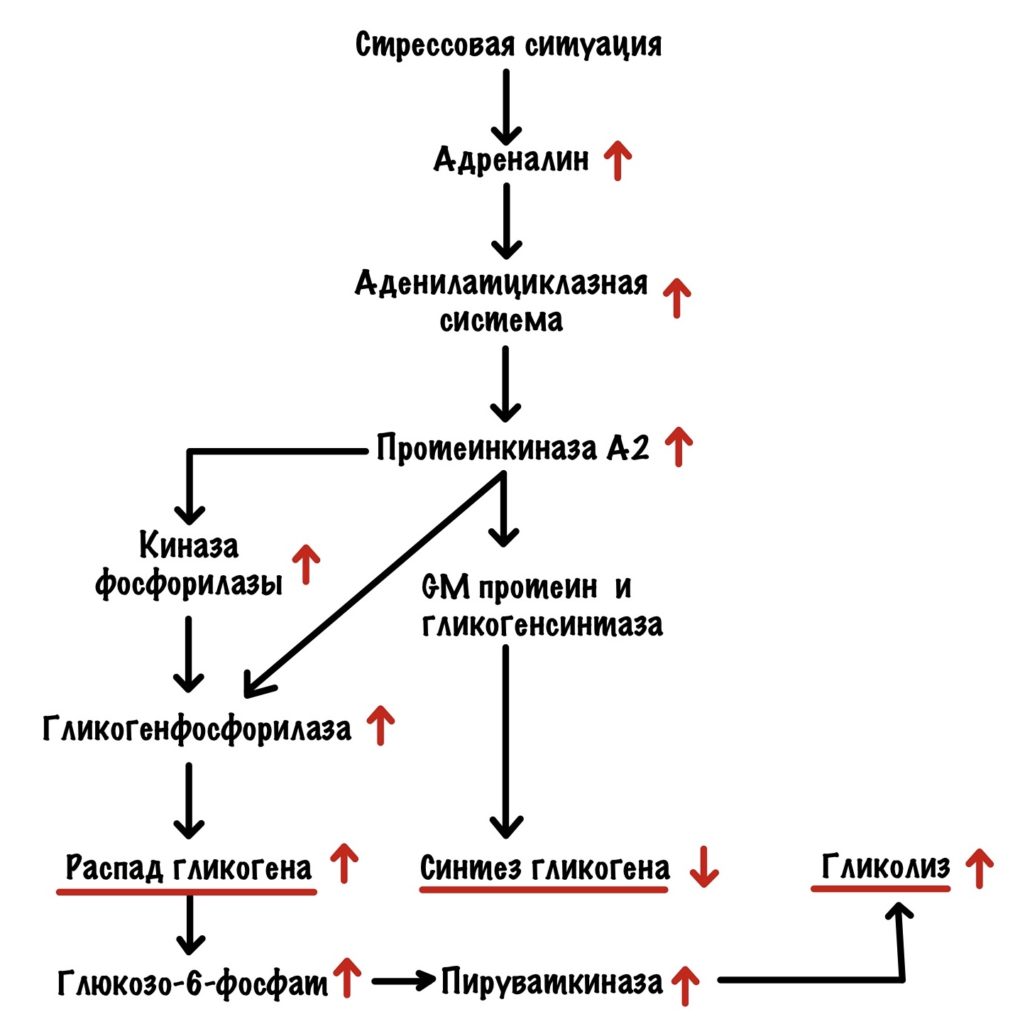
Уровень глюкозы в крови падает, а поджелудочная омывается этой кровью. Она бьёт тревогу с помощью глюкагона. Глюкагон действует на печень через свой рецептор. Это активирует аденилатциклазную систему, самое важное для нас — активация протеинкиназы А2.
Протеинкиназа А2 фосфорилирует киназу фосфорилазы и переводит её в активное состояние, а она начинает фосфорилировать гликогенфосфорилазу. Также она самостоятельно фосфорилирует гликогенфосфорилазу. Это ещё не всё, что делает протеинкиназа А2. Она фосфорилирует GM и ингибитор фосфопротеинфосфатазы I. Фосфопротеинфосфатаза I отщепляется от комплекса и связывается с ингибитором — становится неактивной. Протеинкиназа А2 фосфорилирует гликогенсинтазу а и переводит её в неактивную гликогенсинтазу b. И последнее, она снижает активность пируваткиназы через фосфорилирование — тормозит гликолиз в печени. Ведь печень может и обойтись, а вот мозг — нет. Протеинкиназа А2 переключила выключатель на распад гликогена.
Далее гликогенфосфорилаза отщепляет глюкозо-1-фосфат от гликогена. Фосфоглюкомутаза переводит его в глюкозо-6-фосфат. Глюкозо-6-фосфат отправляют в эндоплазматический ретикулум, где от него отщепляется фосфатная группа с помощью глюкозо-6-фосфатазы. Мы получаем глюкозу, которая выходит из клетки с помощью глюкозных транспортеров второго типа. А она летит кормить наш мозг, ну и другие менее важные ткани.
Стрессовая ситуация
Я бегу от медведя, вы решили заняться спортом или что-то ещё. Мозг передаёт привет надпочечникам: «Пацаны, пора поработать — у нас тут проблема». Надпочечники сваливают всё на мозговое вещество — оно начинает выбрасывать адреналин в кровь. Адреналин действует на мышечную ткань и печень (ещё на много всего, но нам это сегодня не интересно). Начнём с мышечной ткани.
Мышцы
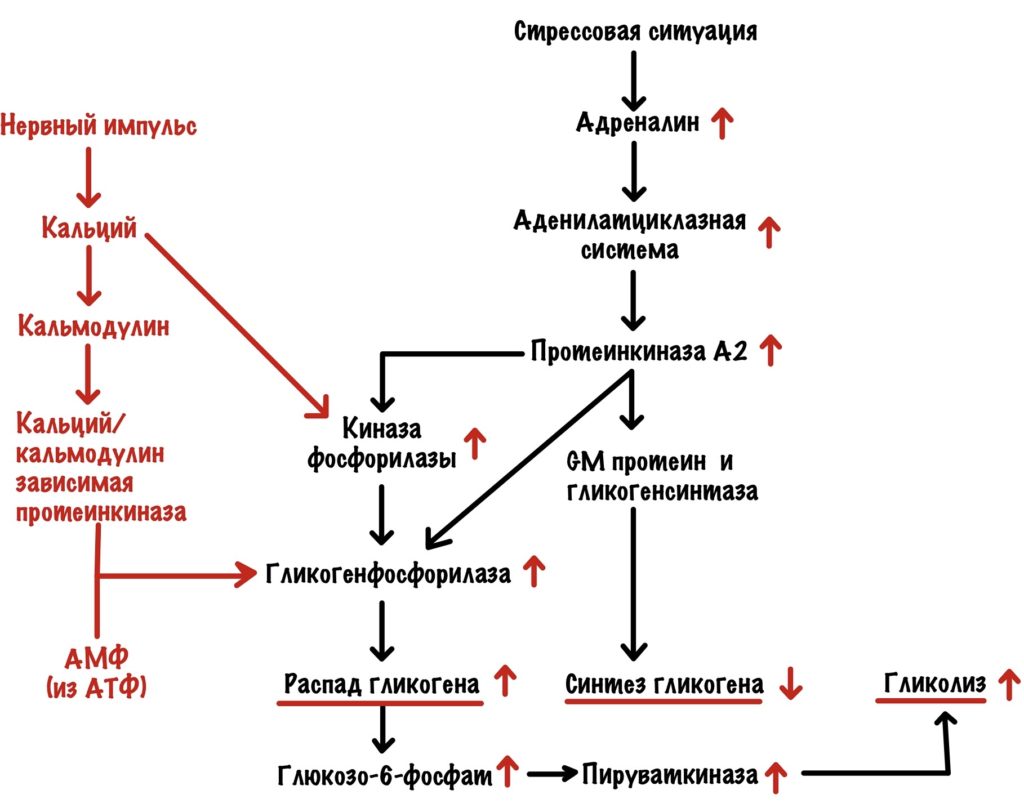
Адреналин действует на бета-2-адренорецептор и запускает аденилатциклазную систему. В итоге активировали протеинкиназу А2. Протеинкиназа А2 действует точно также, как и в печени — мы разобрали это выше. Но есть одно но. Протеинкиназа А2 здесь не влияет на активность пируваткиназы. Но распад гликогена приводит к тому, что растёт концентрация субстратов гликолиза. Поэтому гликолиз в мышцах увеличивается — вся глюкоза идёт на мышечные сокращения. В остальном тоже самое — протеинкиназа А2 активирует распад гликогена и выключает синтез. Но есть и кое-что интересное, а связано это с кальцием.
Кальций появляется в цитоплазме под действием нервного импульса — он открывает кальциевые каналы в саркоплазматическом ретикулуме. Кальций увеличивает активность киназы фосфорилазы — связывается с её дельтой субъединицей. Но ещё он связывается с кальмодулином. Кальций в комплексе с кальмодулином активирует кальций/кальмодулин зависимую протеинкиназу. Эта протеинкиназа тоже фосфорилирует гликогенсинтазу а — переводит её в неактивную b. Вот такой дополнительный винтик в нашей системе.
В мышцах во время работы разрушается АТФ, а значит накапливается АМФ. АМФ действует на аллостерический центр гликогенфосфорилазы b — переводит её в активное R-состояние.
Печень
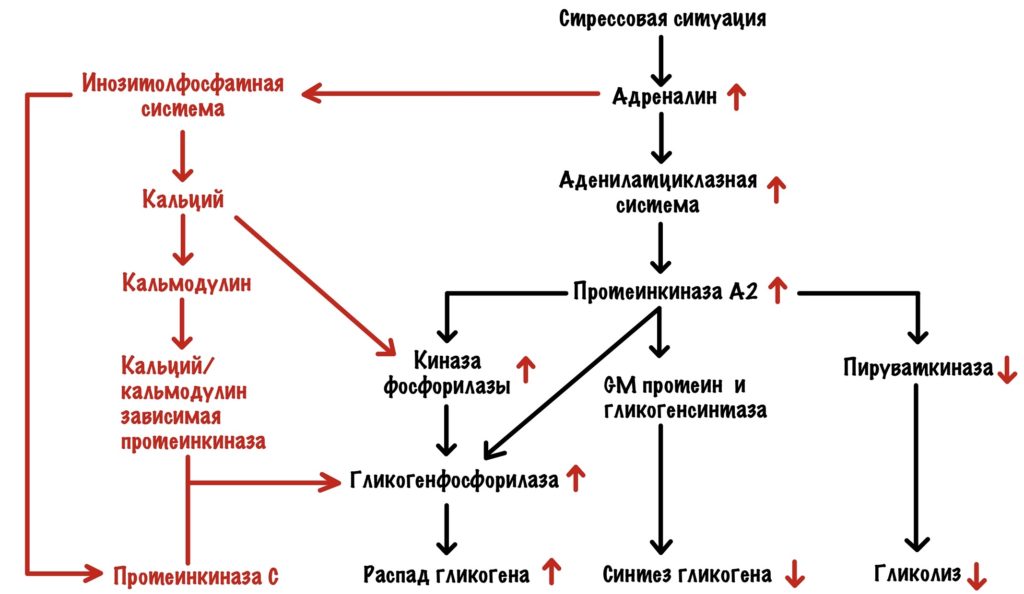
Адреналин действует на бета-2-адренорецепторы и запускает аденилатциклазную систему — тоже самое, что мы разобрали выше. Только здесь снижается активность пируваткиназы: а значит и активность гликолиза. Вся глюкоза должна пойти в кровь — обеспечить мозг и мышцы энергией.
Адреналин действует на альфа-1-адренорецепторы. Запускается инозитолфосфатная система. Это приводит к запуску протеинкиназы C и увеличению кальция в цитоплазме. Кальций активирует киназу фосфорилазы и связывается с кальмодулином. Опять активация кальций/кальмодулин зависимой протеинкиназы, которая фосфорилирует гликогенсинтазу a. Ещё её будет фосфорилировать наша новенькая протеинкиназа C. Ещё один дополнительный винтик!
После еды
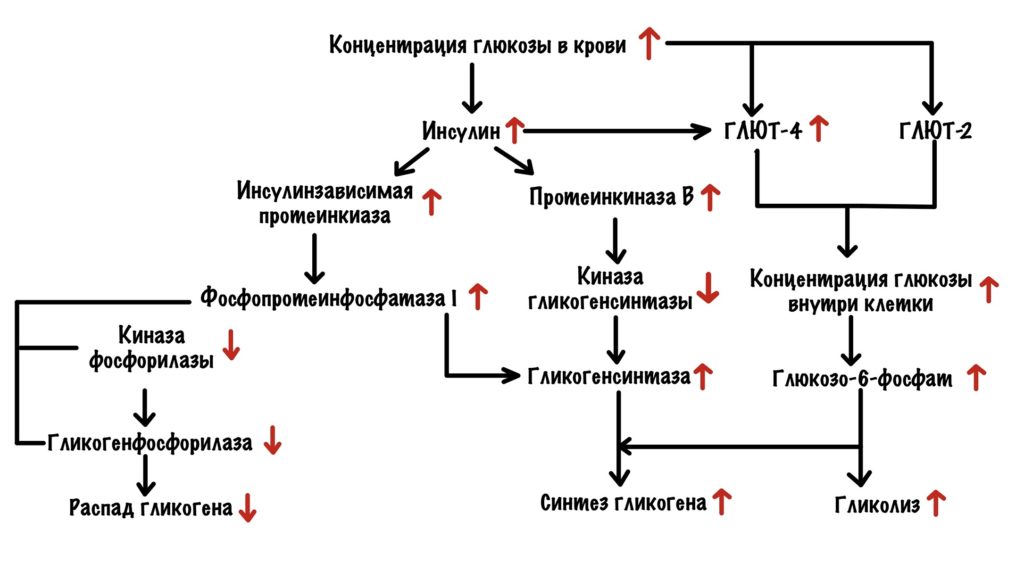
Мы плотно поели — концентрация глюкозы в крови выросла. Кровь омыла поджелудочную железу, а она выбросила инсулин. Инсулин действует на печень, мышцы и жировую ткань. Нам важно, что он вызывает встраивание ГЛЮТ-4 в клетках мышечной и жировой ткани. ГЛЮТ-4 занимаются транспортировкой глюкозы внутрь клетки. В печени другой другой глюкозный транспортёр — ГЛЮТ-2. С их помощью глюкоза залетает в клетку.
Концентрация глюкозы внутри клеток печени и мышечной ткани растёт. В мышечной ткани увеличивается концентрация АТФ и глюкозо-6-фосфата. Они присоединяются к аллостерическим центрам гликогенфосфорилазы b — переводят её в неактивную T-форму. В печени глюкоза присоединяется к глигокенфосфорилазе a и переводит её в неактивную T-форму. Глюкозо-6-фосфат присоединяется к аллостерическому центру гликогенсинтазы b — переводит её в активную форму.
Но вернёмся к инсулину. Инсулин может действовать по двум путям: ядерному и Ras-пути. Через ядерный путь он вызывает экспрессию генов гексокиназы и пируваткиназы — увеличивает их синтез. Больше гексокиназы — больше глюкозы переводится в глюкозо-6-фосфат. Больше глюкозо-6-фосфата — больше глюкозы запасётся в клетке.
Ras путь одинаков в печени и мышцах. Приводит к активации протеинкиназы B и других киназ. Протеинкиназа B фосфорилирует киназу гликогенсинтазы, что переводит её в неактивную форму. Останавливает фосфорилирование гликогенсинтазы. Киназы фосфорилируют GM протеин, что переводит фосфопротеинфосфатазу I в активную форму. Она дефосфорилирует киназу фосфорилазы, гликогенфосфорилазу и гликогенсинтазу. Активируется гликогенсинтаза, но отключается киназа фосфорилазы и гликогенфосфорилаза. Запуск синтеза гликогена и отключение его распада. Ещё фосфопротеинфосфатаза I дефосфорилирует пируваткиназу в печени — переводит её в активную форму. Поэтому гликолиз при действии инсулина растёт.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.