Строение атома. Гибридизация орбиталей
Обычно в начале статьи пишут краткий план того, о чем пойдет речь в статье. Еще добавляют зачем и почему на нее нужно тратить время. Но здесь такого не будет, потому что я не уверен — нужна ли она вообще.
Но я расскажу историю. Вообще статья должна была быть про белок, как формируется первичная, вторичная структура, ну и так далее. И вот идет подготовка материала, а там довольно большую роль играет электроотрицательность. На самом деле не очень и большую, но все-таки роль у нее есть. И вот мне стало интересно, а как она формируется? Ты конечно знаешь, что она растет в периодической таблице слева направо и зависит от радиуса атома. Но почему? В общем-то эти вопросы привели меня к строению атома и закону Кулона. Поэтому сейчас мы устроим маленькое путешествие в химию и физику. Начнем со строения атома. А уже в следующей статье будем разбираться с электроотрицательностью.
Планетарная модель строения атома от Резерфорда
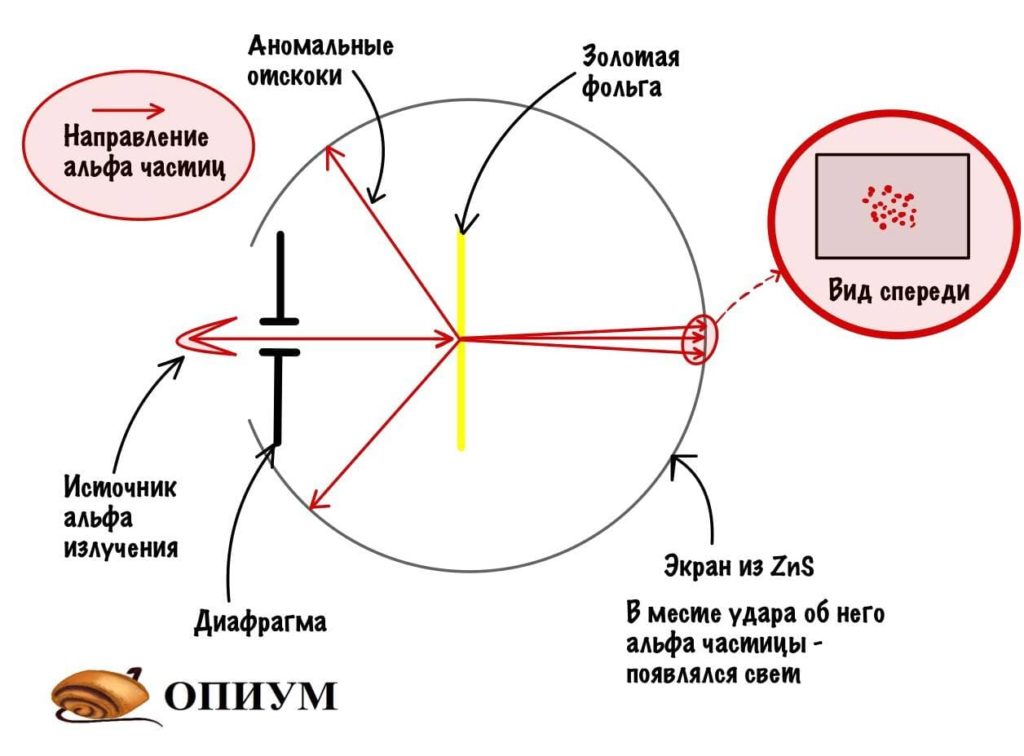
Это модель ключевая, потому что на ее основе строились все остальные. Вообще Резерфорд крутой мужик, который очень любил всякие опыты. Вот один из них:
Резерфорд взял источник альфа-частиц и направил его на фольгу из золота. Диафрагма нужна для того, чтобы альфа-излучение направлялось только к фольге, а не разлеталось в разные стороны. При прохождении альфа-частиц через атомы золота они отклонялись, а место их удара отмечалось на цинковом экране (он светится, когда на него попадает альфа-частица). Ничего удивительного, у атома есть заряд, и он вызывает отклонение частиц. Но тут случилось кое-что необычное: очень редко альфа-частицы отскакивали в другую сторону — к месту их «запуска». Резерфорд очень удивился и сказал: «Да это примерно тоже самое, что стрелять по тряпке из ружья и получить пулю в лоб». Конечно, не дословно, но смысл примерно такой.
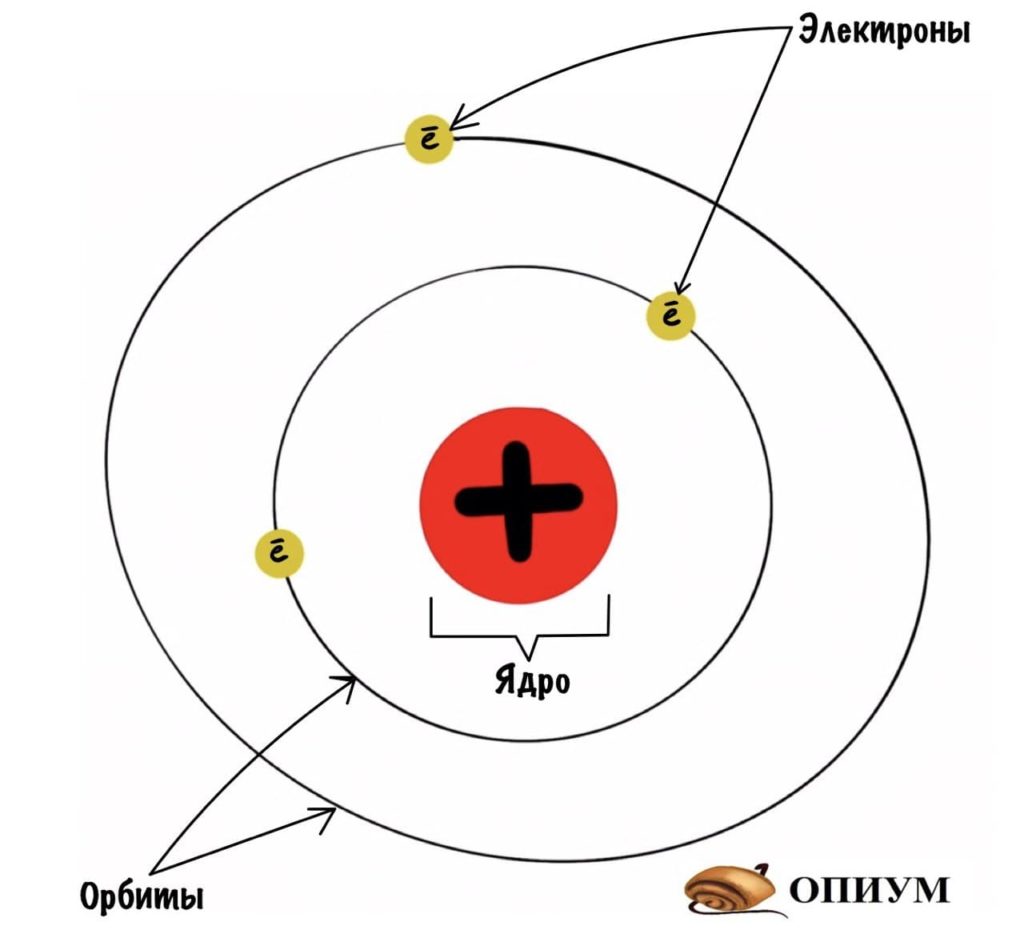
Какие выводы делает Резерфорд из этого опыта? Он предполагает, что основная масса атома сосредоточена в его ядре — когда альфа-частицы попадают в него, то отскакивают в обратную сторону. Ядро очень маленькое и заряжено положительно, а вокруг него по орбитам летают отрицательно заряженные электроны. Он называет это планетарной моделью. Очень красиво, согласитесь? Мы живем в мире, который находится в солнечной системе. А атомы, из которых состоит все вокруг, имеют строение такой же системы.
Это все очень поэтично и красиво, но есть парочка проблем:
- Если электроны летят по орбите, то у них есть скорость, и они излучают электромагнитные волны — или энергию. А значит они быстро ее потратят и упадут на ядро.
- Некоторые атомы излучают свет — фотоны. Это называется спектром. Но при такой модели им неоткуда взять такое количество энергии. Мало того, что они падают на ядро, так им еще и излучать что-то нужно. Не очень все это складывается.
Были и еще проблемы, но это основные. Как же их решить?
Полуклассическая модель атома по Бору
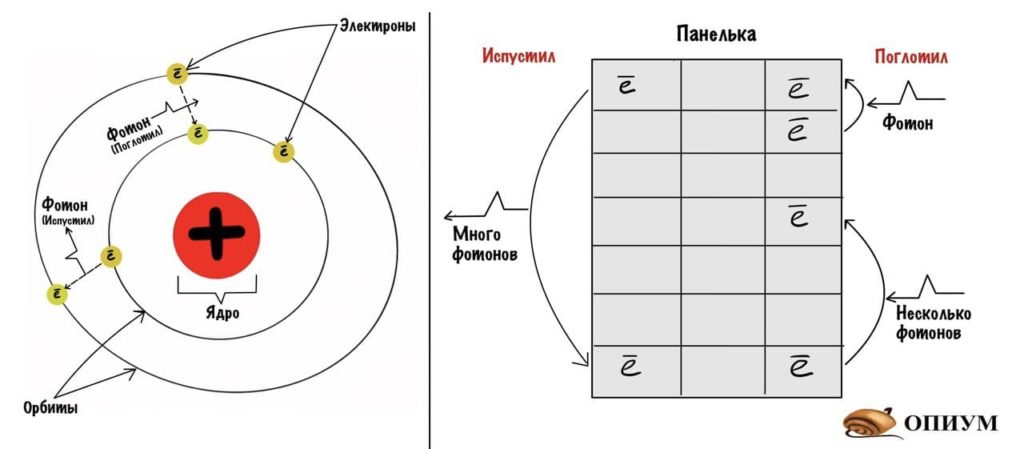
Появляется второй крутой мужик. Может быть, он даже круче первого, потому что говорит такое — от чего волосы у физиков встают дыбом. Бор взял модель атома по Резерфорду и сказал что-то вроде: «Давайте предположим, что электроны движутся по орбитам, но никакую энергию они не излучают. Но если электрон перепрыгивает с одной орбиты на другую, то он выделяет энергию — фотоны. Это и есть спектр!»
Бор назвал состояние атома, когда его электроны движутся по свои орбитам, стационарным состоянием. При перепрыгивании одного электрона на другую орбиту атом становится возбужденным и может выделять энергию. Атом становится возбужденным не просто так — он поглощает какую-то энергию извне, она представляет собой фотон или фотоны.
Переведем Бора на язык физиков: “Вся ваша физика полная туфта. Атому на нее плевать, он живет по другим законам”. И все как бы в шоке, но больше всех Эйнштейн — он становится главным хейтером Бора. Но экспериментально модель Бора подтверждается.
Модель Бора чем-то похожа на дом. Представьте себе панельку. Если электрон упадет с 7 этажа на первый, то он выделит энергию — это и есть фотон. А вот если зарядить как следует атом, то электрон может прыгнуть с первого этажа на пятый. Чем больше зарядишь, тем выше прыгнет. Чем с большей высоты упадет, тем больше выделит энергии. Примерно так. Оказалось, что Бор был прав и дальше мы это увидим.
Резерфорд, кстати, сделал предположение, что ядро состоит из положительно заряженных протонов. Но Резерфорд и Бор еще не знали, от чего зависит количество электронов и протонов, но с этим разберутся попозже.
Современная модель атома
Ну а дальше началось самое интересное — физики взяли модель атома по Бору и добавили к ней своего добра. Так получилась современная модель атома. Конец! Ну или не совсем. Атом состоит из ядра и электронной оболочки. Начинаем с ядра.
Ядро атома
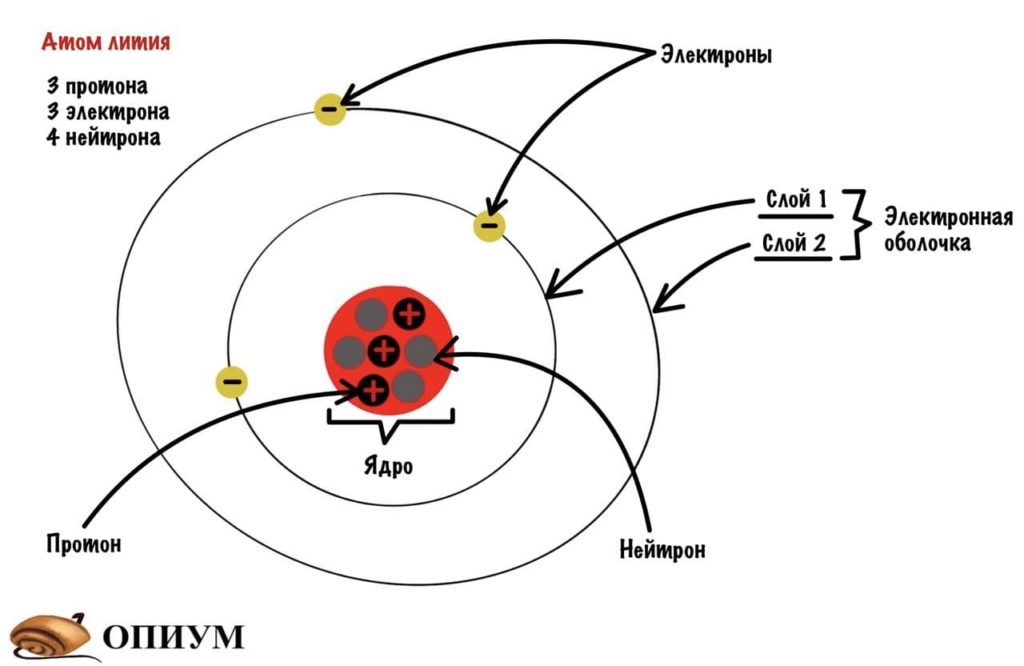
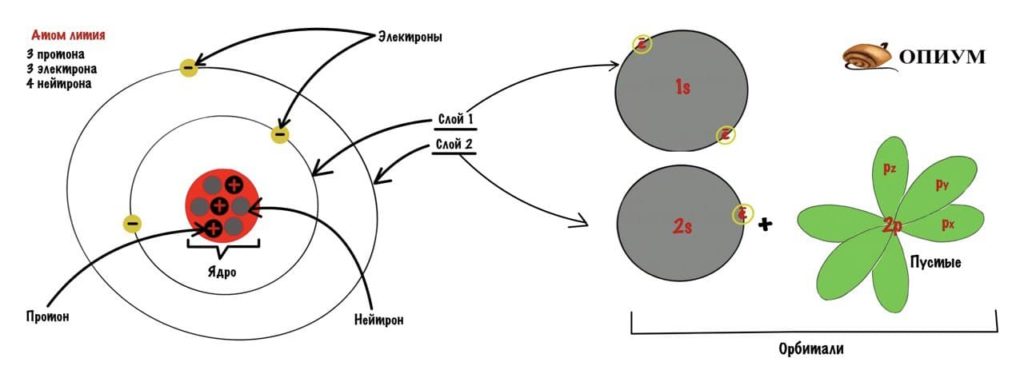
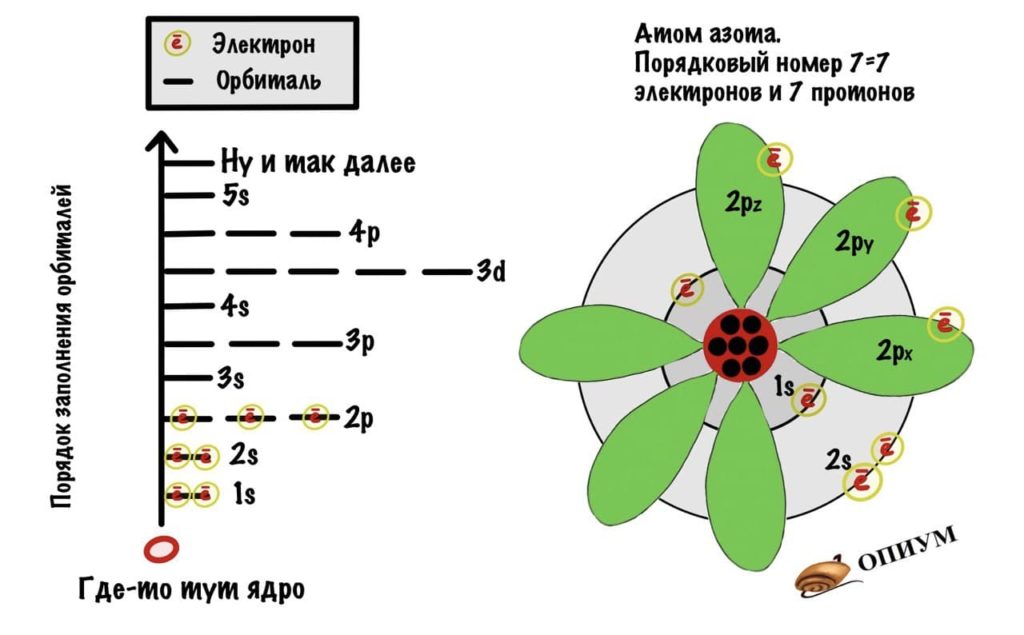
У атома есть ядро, которое состоит из протонов и нейтронов. Протоны заряжены положительно, а у нейтронов заряда нет. Количество протонов и электронов равно — зависит от порядкового номера в таблице Менделеева. Если это атом азота, то у него 7 протонов и 7 электронов. Нейтрон такому правилу не подчиняется — их может быть больше, а может и меньше. Протон и нейтрон весят в примерно 1800 раз больше, чем электрон. Поэтому основная масса атома находится в ядре.
На самом деле протон и нейтрон состоят из других частиц, но не будем слишком глубоко копать. Можешь почитать, если интересно.
Электронная оболочка
Электронная оболочка — это все электроны атома. Она состоит из слоев, на которых располагается какая-то часть электронов.
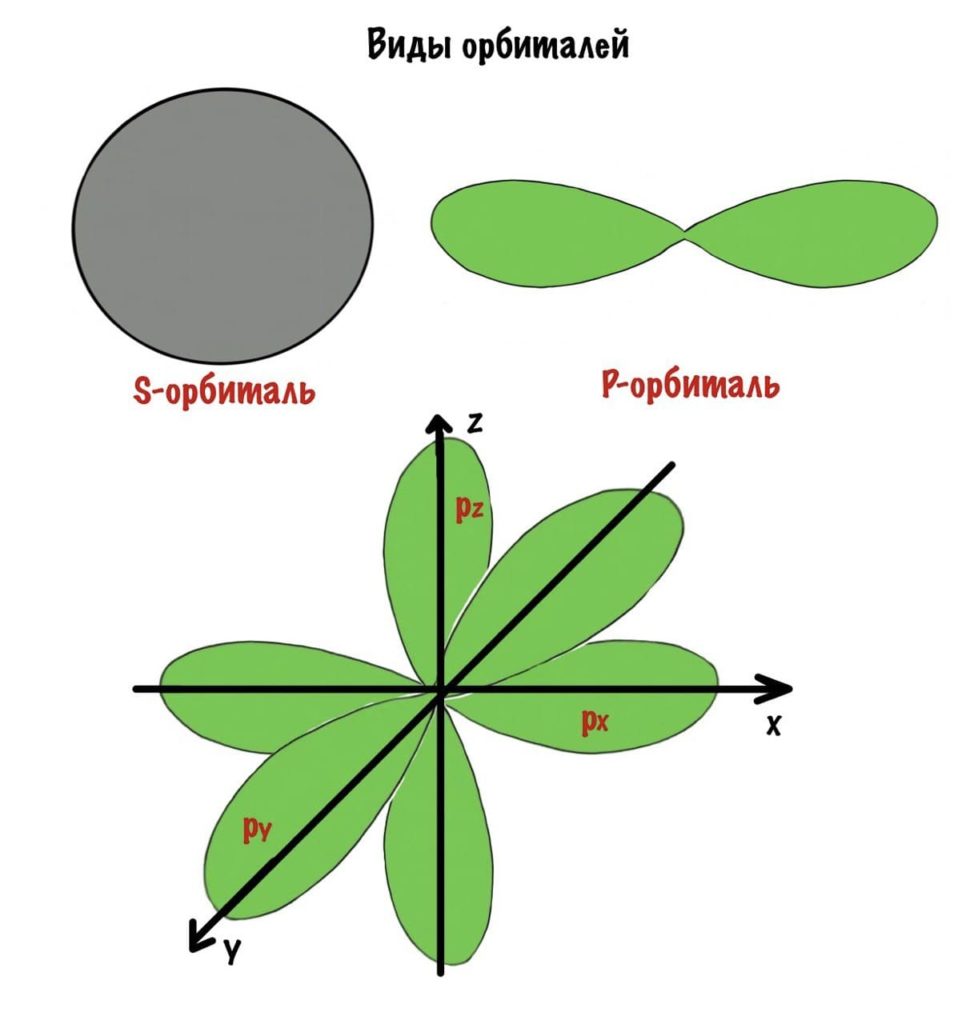
Каждый слой состоит из орбиталей. Заметили? Не орбит, а орбиталей. Орбита — это траектория движения тела, на которой в какой-то момент времени можно его встретить. Помните круговые поливалки в деревне? Вода из них движется по определенной траектории. Можно встать и подождать пока тебя польют в жаркий день. Орбиталь — это другое дело, на ней электрон проводит 90 процентов времени, но как он там движется — одному ему известно. Поэтому можно стоять очень долго, но так и не дождаться пока тебя польют. Пример не очень, согласен. Лучше бы привел Луну или какую-нибудь планету, но вы поняли…
Есть 4 вида орбиталей: s, p, d и f. S- это сфера, p — бесконечность или гантелька, d и f сложнее. Я их рисовать не буду, потому что они нас не интересуют. P-орбиталей всегда 3 — px, py, pz.
Слои электронной оболочки
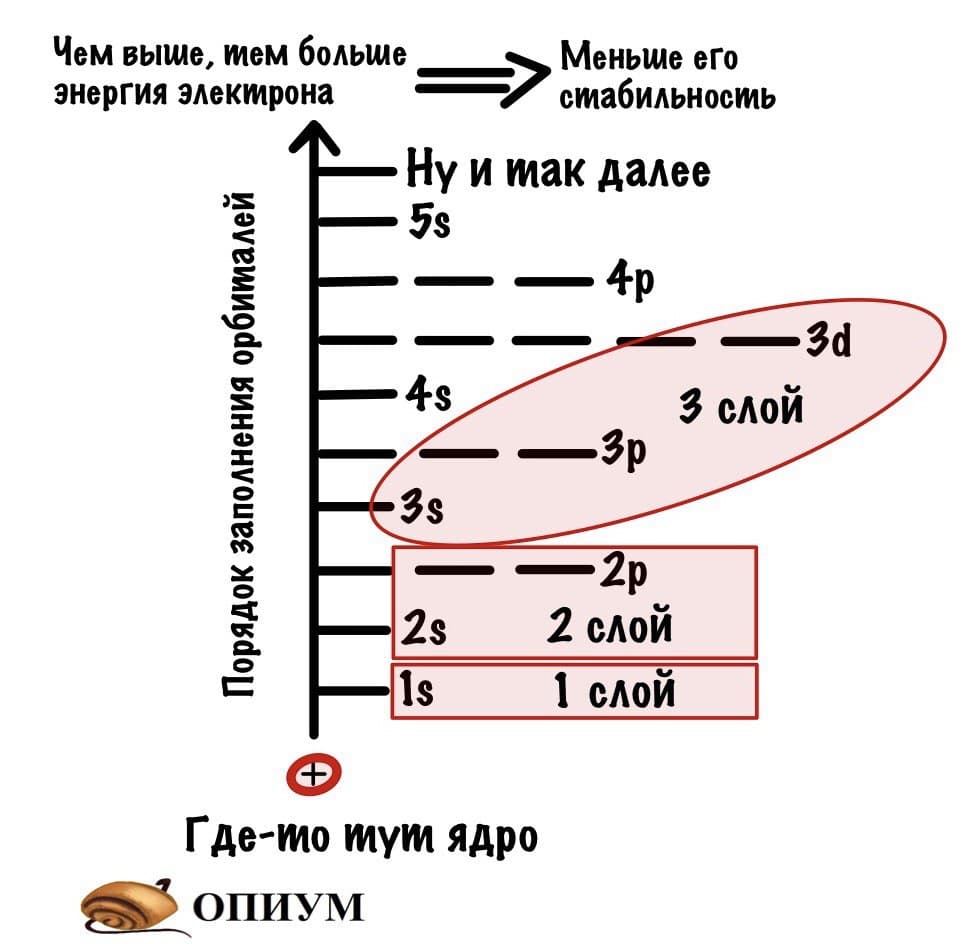
Теперь подробнее про слои. Первый слой состоит только из одной орбитали — s. Второй слой: одна s и три p орбиталей. Третий слой — одна s, три p и пять d орбиталей. Ну а на четвертом за 5d орбиталями добавятся еще 7f. Количество слоев зависит от количества электронов, а значит от порядкового номера атома.
Тут есть определенные правила:
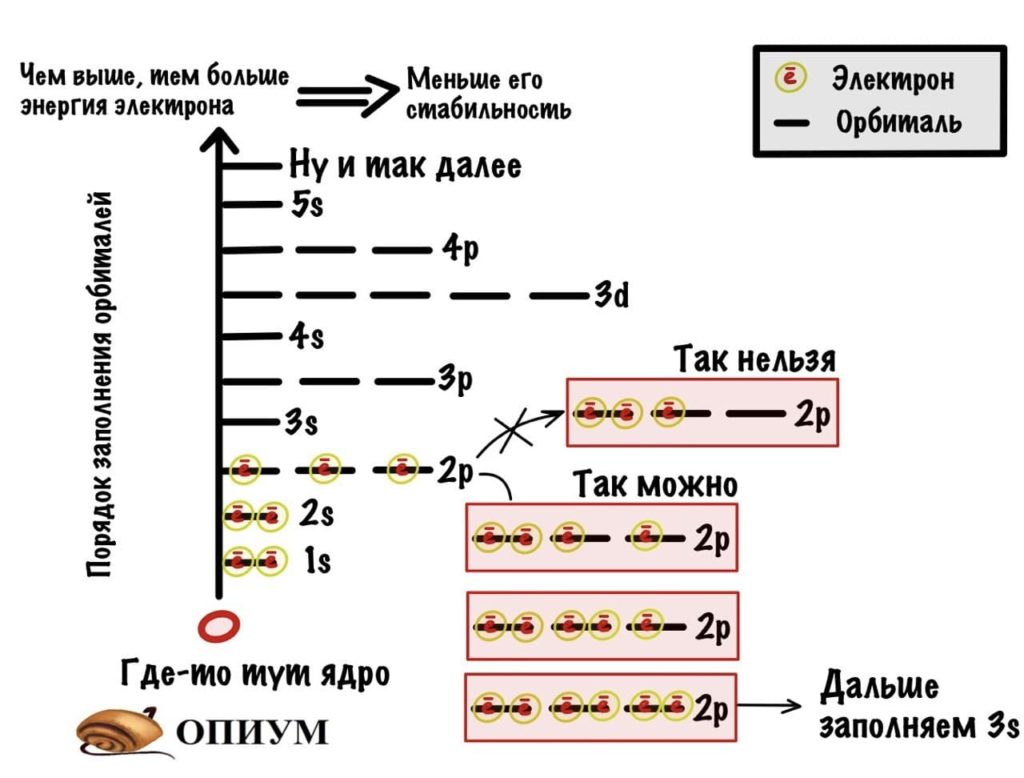
- На каждой орбитали могут находиться только два электрона.
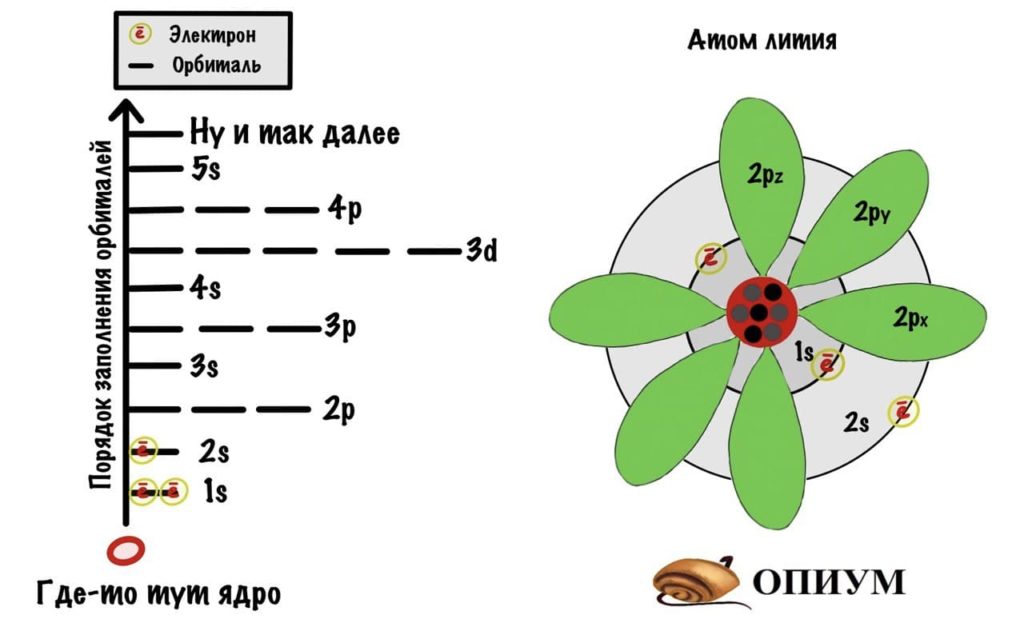
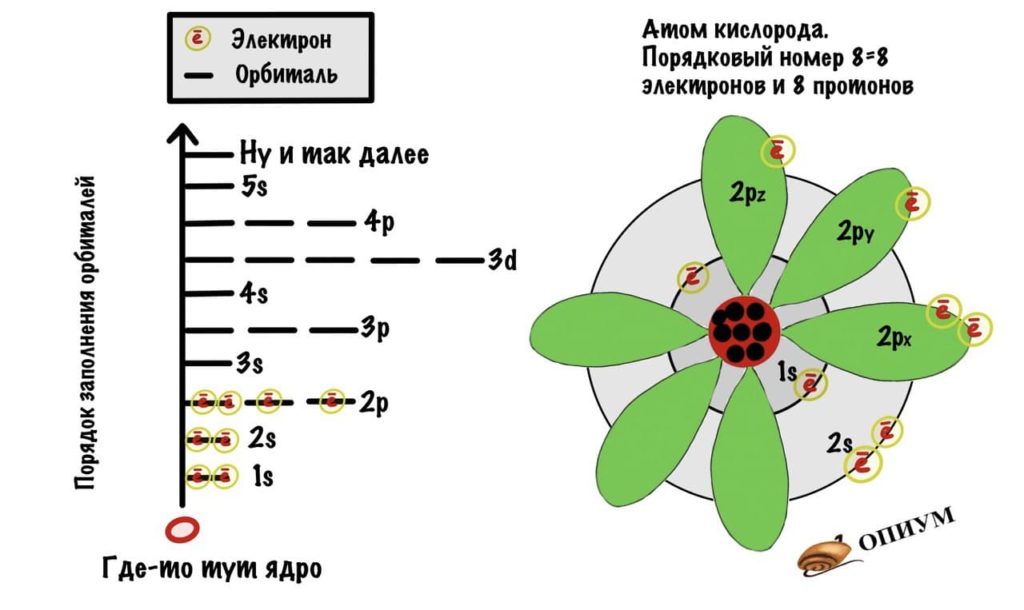
- Орбитали заполняются с определенной последовательностью, она видна на картинке.
- Чем дальше орбиталь от ядра атома, тем больше ее энергия и энергия электрона на ней.
- Электрону выгоднее быть на орбитале и слое, которые ближе всего к ядру атома. Там его энергетическое состояние стабильнее, так как меньше энергия. Поэтому электроны стремятся упасть вниз — прямо как я по социальной лестнице, ой.
Добавим к атому лития, который я показывал до этого, орбитали и получим что-то такое.
Можно еще попробовать свести орбитали в один рисунок, смотрите.
А вот азот.
И кислород.

Химические связи чаще всего образуются за счет неспаренных электронов, но подробнее об этом поговорим в следующей статье. А сейчас нас интересует углерод и гибридизация его орбиталей.
Гибридизация орбиталей
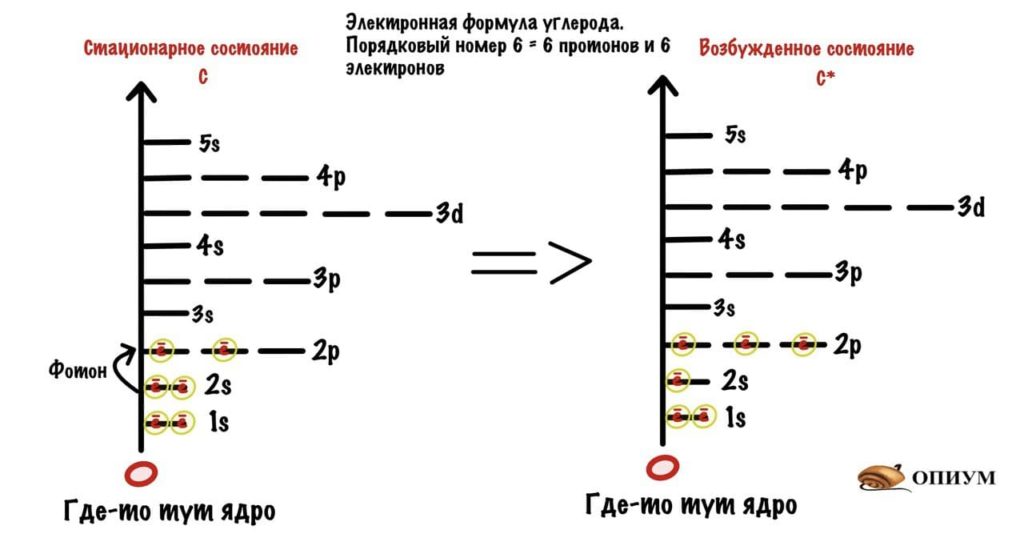
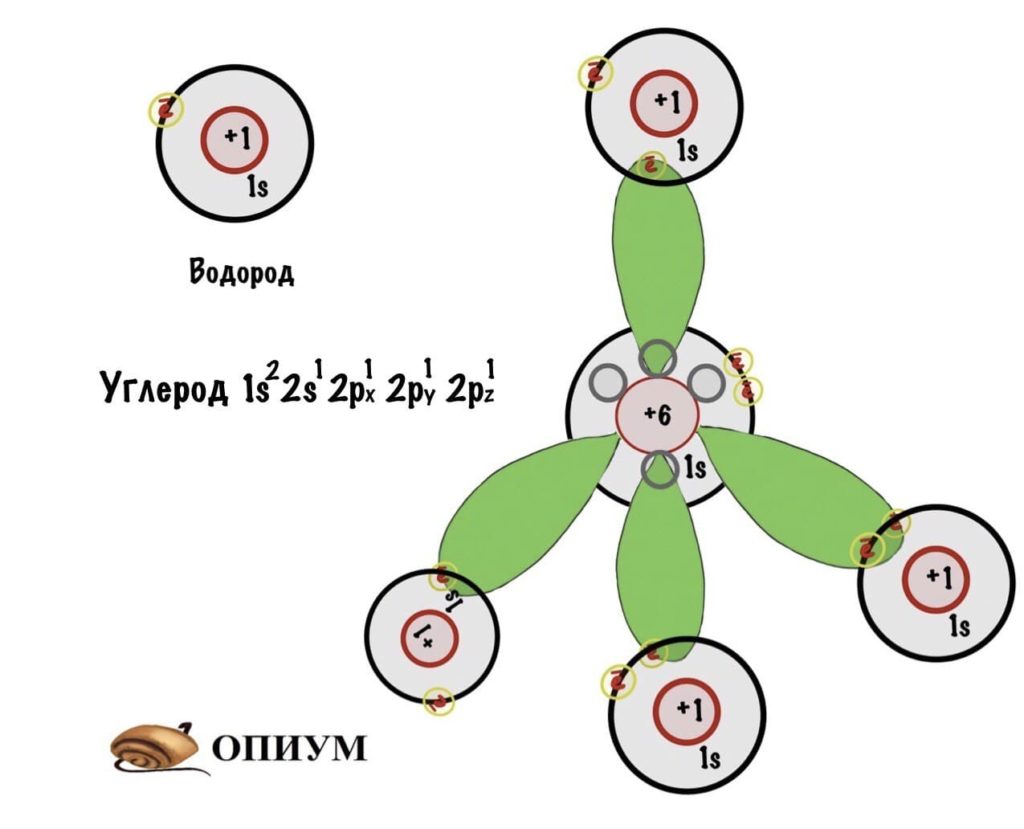
Сначала посмотрим на электронную формулу углерода и вспомним о Боре. В стационарном состоянии у углерода всего два электрона на 2p-орбиталях. Однако, если атом углерода поглотит энергию фотона, то электрон с 2s-орбитали может перейти на 2p-орбиталь — атом углерода становится возбужденным. В таком состоянии он может образовать 4 связи, т.к. у него 4 неспаренных электрона.
И тут встал вопрос. Атом углерода в возбужденном состоянии может образовать четыре связи, так как у него четыре неспаренных электрона. Но энергия связей будет разной, потому что эти электроны располагаются на разных орбиталях (у p орбитали энергия побольше). Это не очень хорошо сказывается на стабильности системы. Как выйти из этого положения? Атом придумал интересную штуку — он изменил форму и размеры орбиталей. Это и есть гибридизация.
sp3-гибридизация
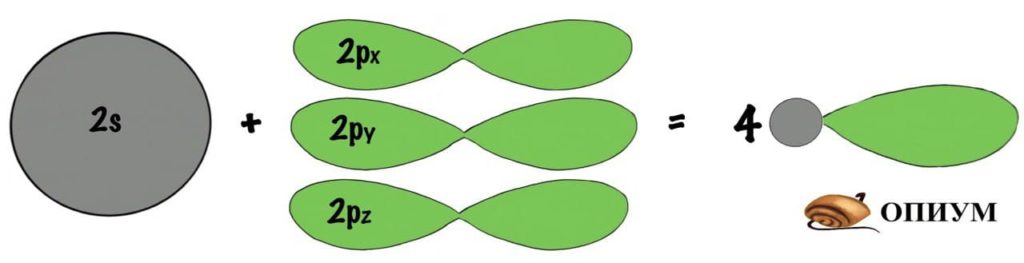
Когда три p орбитали объединяются с одной s, тогда получается sp3-гибридизация. Форма молекулы примерно такая:
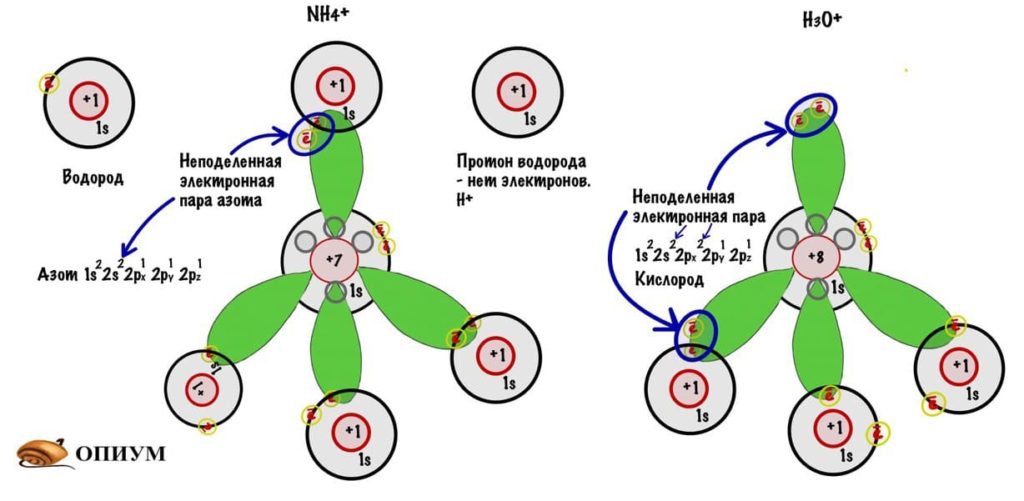
И на рисунке не особо понятно, но это тетраэдр или правильная треугольная пирамида. Просто рисовать в плоскости у меня не особо хорошо получается. Здесь между орбиталями легендарный угол — 109о28‘. В организме почти весь углерод в такой гибридизации. Но не только у него бывает sp3-гибридизация. В молекулах аммиака и воды тоже такая гибридизация, но с нюансом, смотрите.
У азота есть одна неподеленная электронная пара на втором энергетическом слое, а именно на 2s-орбитали — там находится два электрона и третий туда уже не засунуть. Но азот может отдать протону водорода один электрон по донорно-акцептерному механизму и образовать связь. Так возникает ион аммония. Такая же тема с водой, но кислород не может отдать по электрону от каждой электронной пары — только с одной! Так образуется ион гидроксония.
sp2и sp-гибридизация
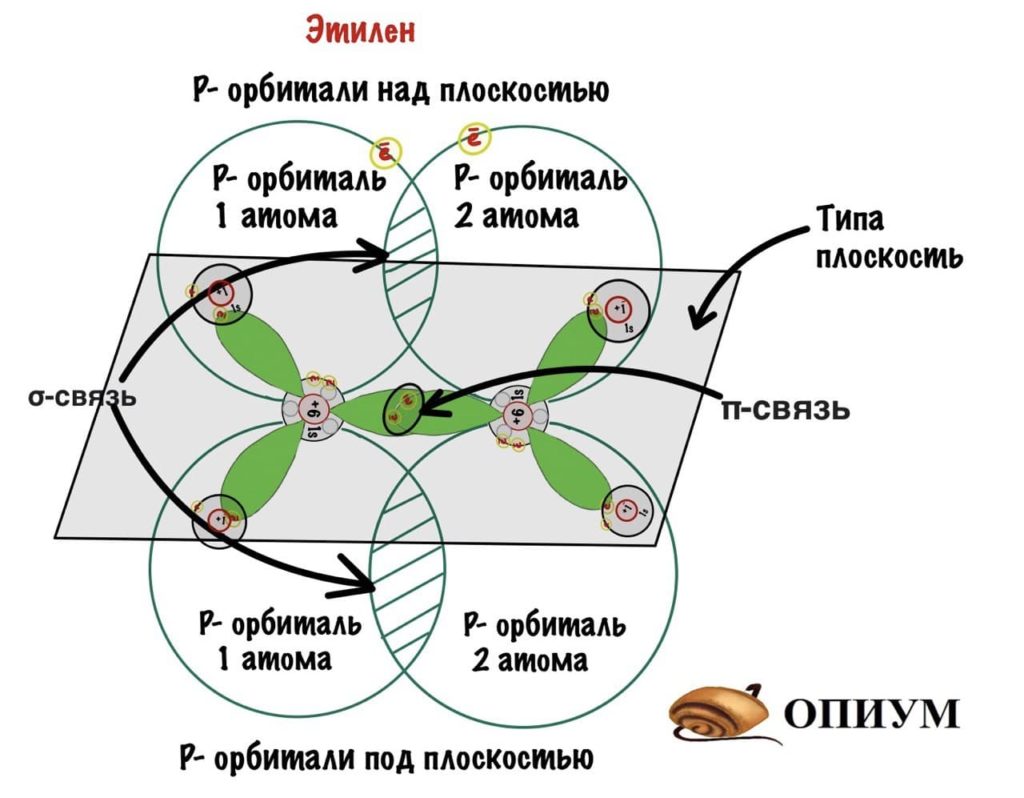
Название говорит само за себя. При sp2-гибридизации одна p-орбиталь остается без изменений, а две другие гибридизируются с s-орбиталью. Все орбитали лежат в одной плоскости под углом 120 градусов.
Куда пропала p-связь? Ну ладно, держите формулу этилена со всеми связями.
На рисунке видно, что p-орбитали без гибридизации находятся над и под плоскостью, они образуют сигма-связь — эта связь более жесткая, чем пи-связь. Поэтому вращение вокруг нее ограничено.
sp-гибридизацию нарисовать не смогу, сорян. Но смысл вы поняли: без изменений останутся две p-орбитали, а две sp-орбитали будут похожи на палочку — угол между ними будет 180 градусов. Одна p-орбиталь будет идти над плоскостью, а другая смотреть в лицо. Надеюсь, что у тебя получилось представить. Едем дальше.
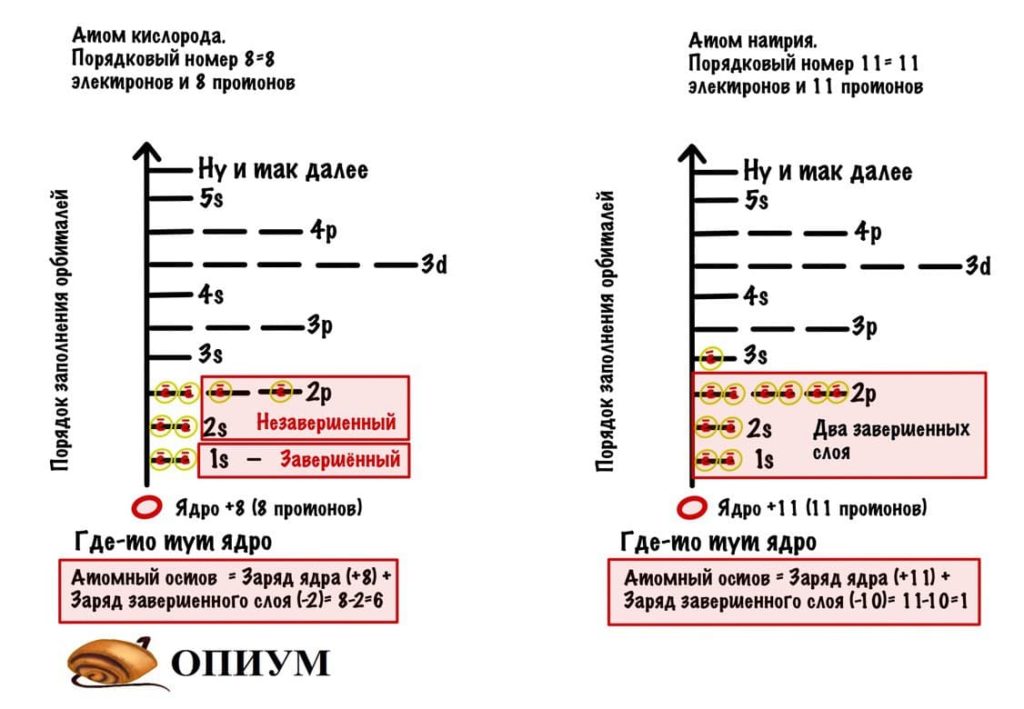
Атомный остов
Есть еще такое понятие — ядерный остов, оно понадобится нам дальше. Сейчас быстро разберемся с ним.
Электронный слой бывает завершенным или незавершенным:
- Завершенный, если все орбитали заняты электронами.
- Незавершенный, если заняты не все.
Заряд ядра атома (количество протонов) + заряд завершенных слоев (количество электронов) = атомный остов. Картинка….
У кислорода заряд атомного остова больше, чем у натрия. Это нам понадобится, когда будем считать электроотрицательность.
Фух, со строением атома закончили. Поздравляю всех, кто дочитал до этого момента!!! Дальше можно переходить к электроотрицательности, но это уже в следующей статье.