Регуляция гликолиза и глюконеогенеза
Регуляцию гликолиза и глюконеогенеза удобнее разбирать вместе. Потому что они работают реципрокно. А если проще, то по принципу выключателя в комнате: когда один процесс включён, то другой выключается. И наоборот.
Но нельзя включать гликолиз и глюконеогенез одновременно. Так в клетке будет ужасная неразбериха. Ведь у гликолиза и глюконеогенеза одинаковые субстраты. Так что, когда один процесс включён, то другой выключается. И наоборот.
И тут появляется проблема, потому что гликолиз идёт везде, а глюконеогенез в печени, корковом веществе почек и слизистой тонкого кишечника. Получается, что в большинстве тканей есть гликолиз, но нет глюконеогенеза. А это значит, что там не может быть реципрокной регуляции. Так что регуляция гликолиза различна — всё зависит от ткани.
Поэтому давайте сначала посмотрим на регуляцию гликолиза в мышечной ткани . А вот реципрокную регуляцию гликолиза и глюконеогенеза посмотрим на примере печени.
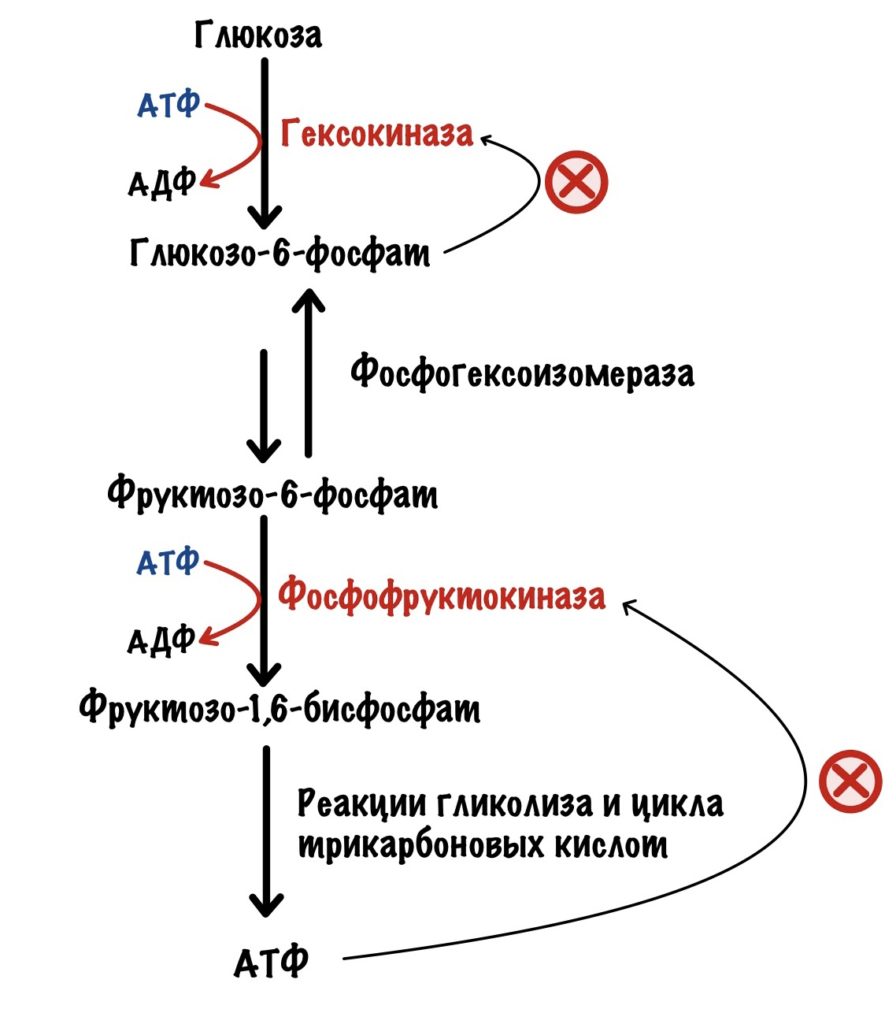
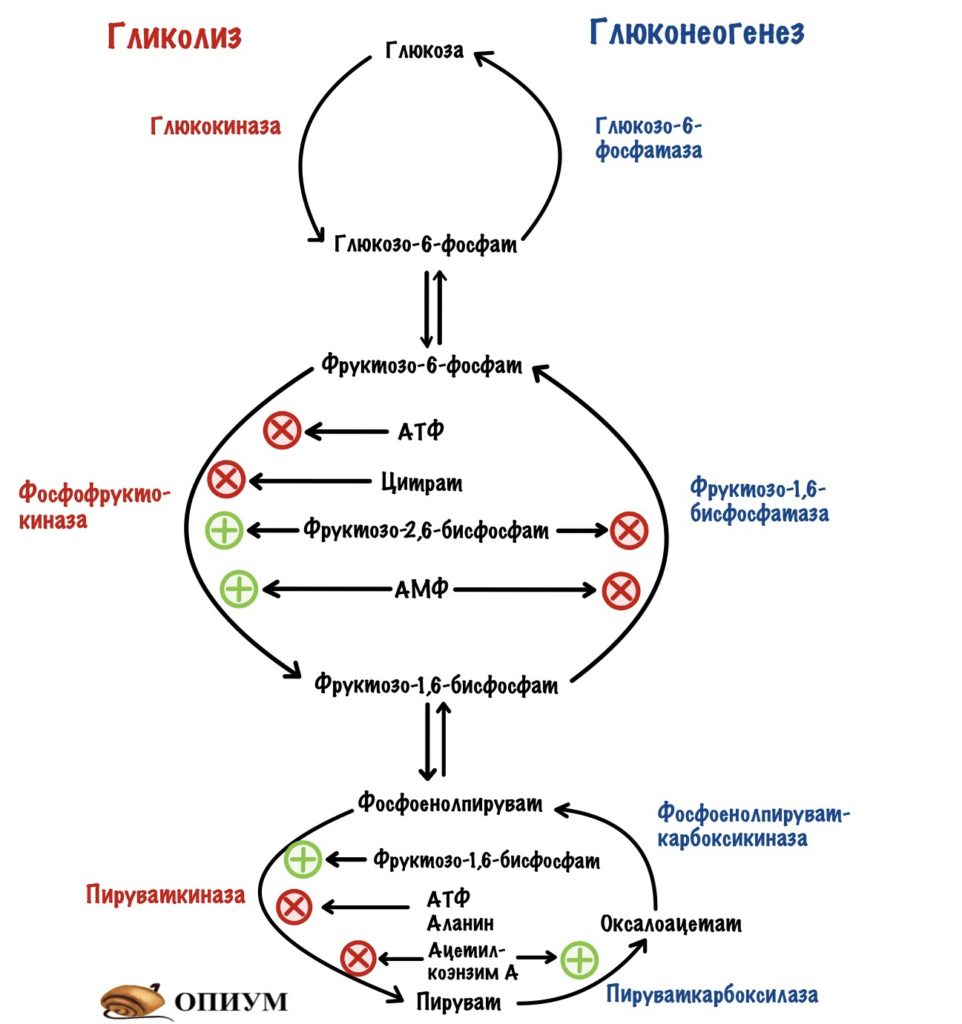
Но сначала кое-что вспомним. Всего в гликолизе десять ферментов, а в глюконеогенезе — одиннадцать. Регулировать каждый слишком запарно. Нужно выбрать какие-то ключевые ферменты. И если мы посмотрим на схему гликолиза и глюконеогенеза, то нам всё станет ясно.
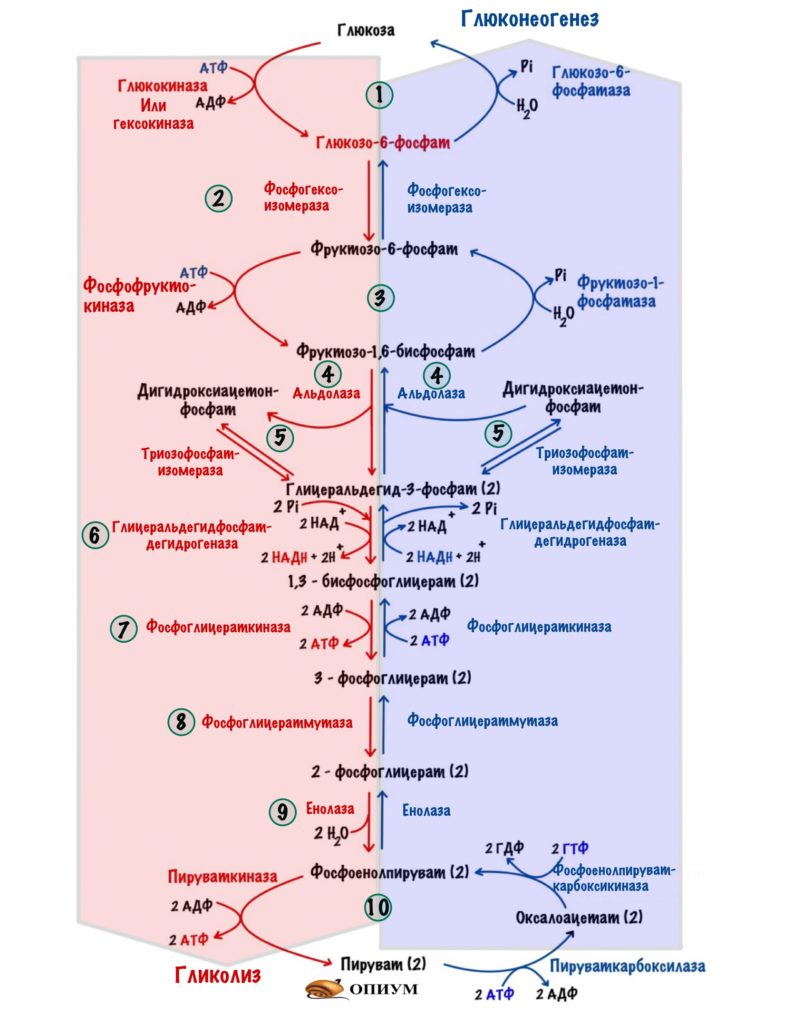

Всего три реакции необратимы для каждого процесса: первая, третья и десятая. При этом десятая в глюконеогенезе разделена на два этапа — её катализируют два фермента. Но суть остаётся такой же.
Регуляция гликолиза идёт через изменение активности или изменения количества: глюкокиназы или гексокиназы, фосфофруктокиназы и пируваткиназы. Глюкокиназа работает в печени, а гексокиназа в остальных тканях.
Регуляция глюконеогенеза идёт через изменение активности или изменения количества: пируваткарбоксилазы/фосфоенолпируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы и глюкозо-6-фосфатазы.
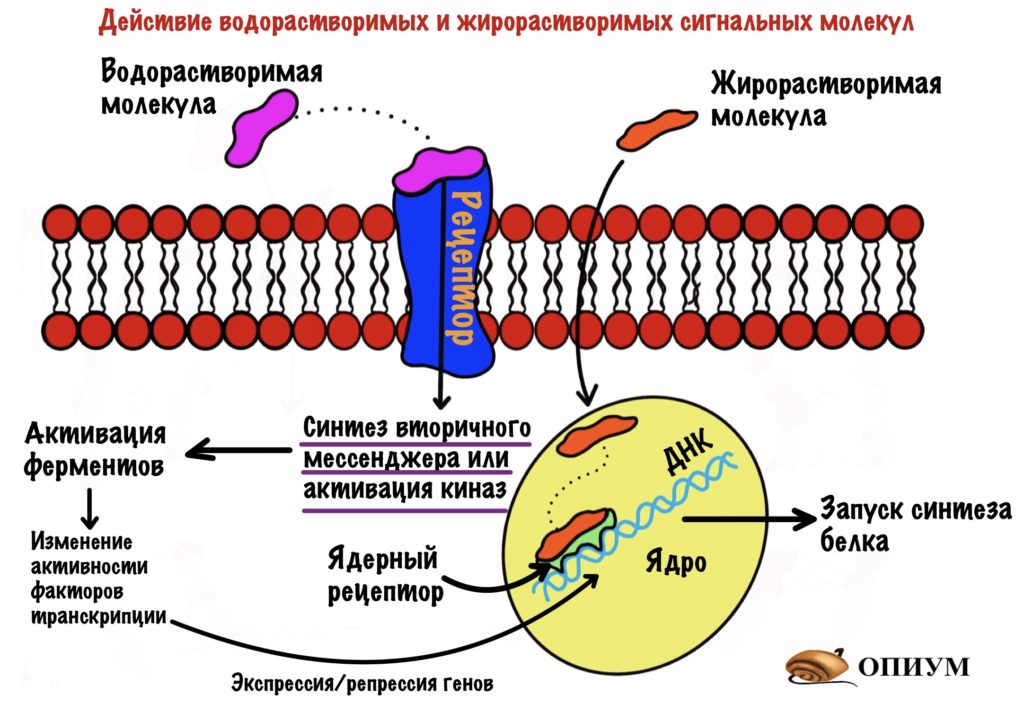
Активность этих ферментов можно изменить двумя путями: аллостерической регуляцией и гормональной. Гормональная регуляция делится ещё на две: фосфорилирование/дефосфорилирование фермента и экспрессия/репрессия его синтеза. Первый вариант быстрый, а вот второй — медленный. Потому что на синтез фермента нужно время, а при репрессии нужно подождать, пока разрушатся ферменты, которые уже были синтезированы.
Теперь можно переходить к регуляции.
Аллостерическая регуляция гликолиза в мышцах
Нужно понять, что мышцы эгоистки и используют глюкозу только для своих нужд.
Регуляция первой реакции
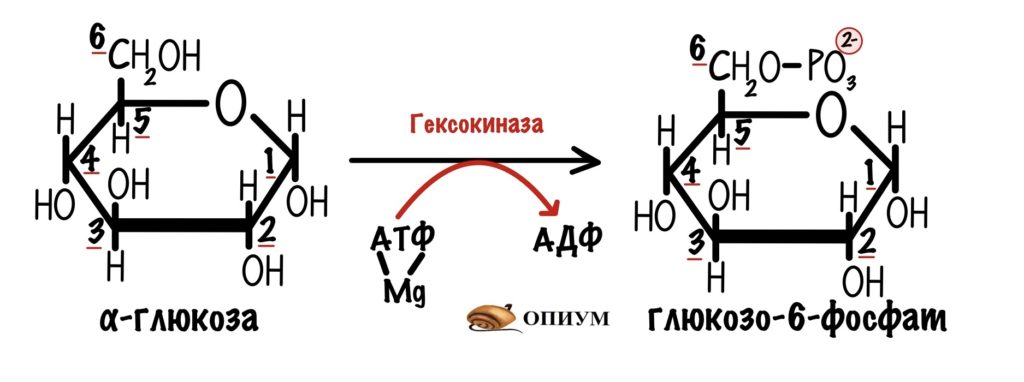
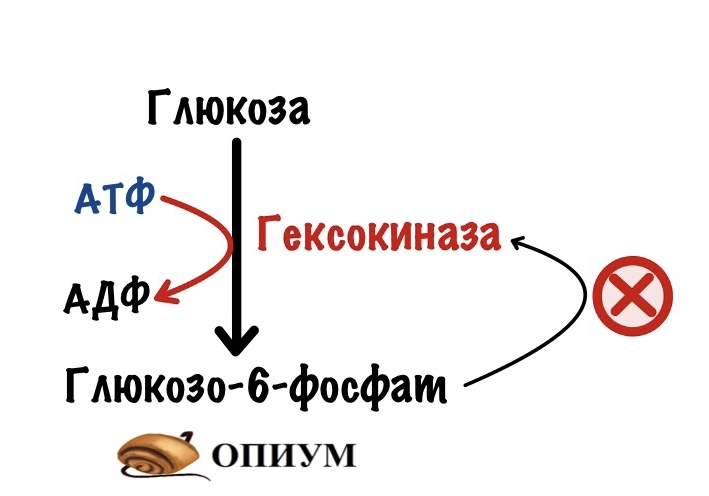
В мышцах её катализирует гексокиназа.
Константа Михаэлиса-Ментена для неё 0.1 ммоль/л. Это значит, что у неё огромное сродство к глюкозе. Получается, что у неё большая эффективность работы при любом значении глюкозы внутри клетки.
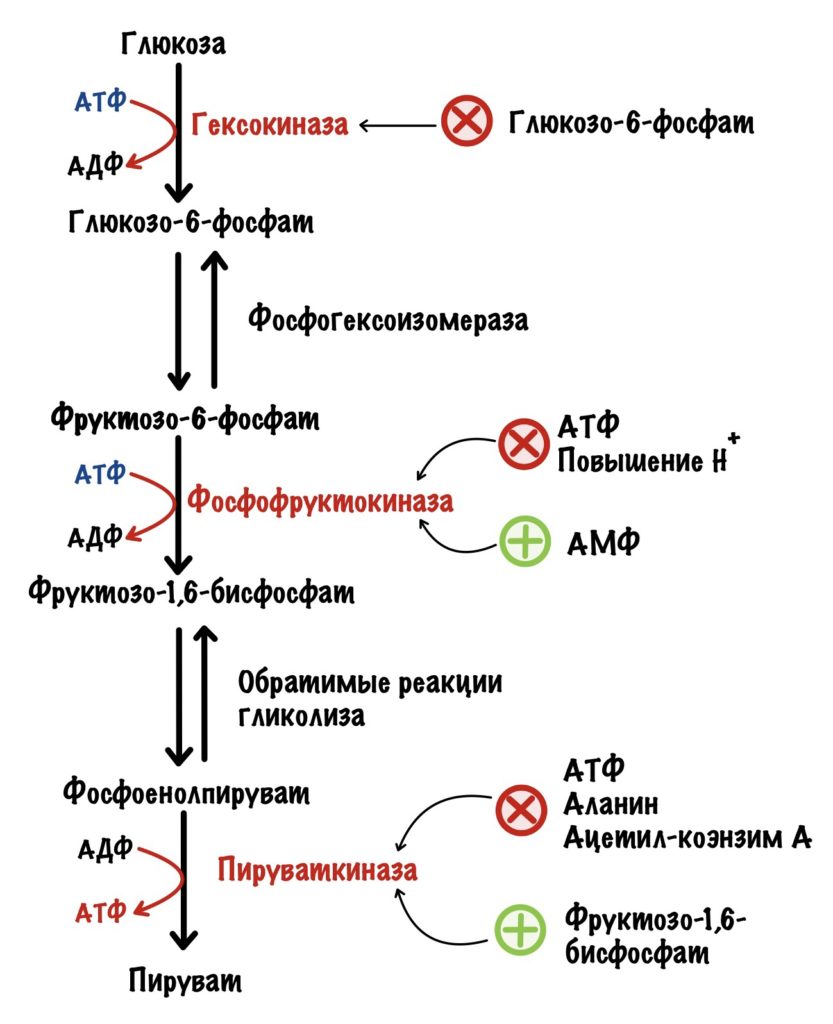
Из-за этого гексокиназа работает как бешеная. Поэтому иногда её нужно притормозить. И это делает глюкозо-6-фосфат. Продукт этой же реакции. Это отрицательная аллостерическая регуляция. Активируется в случаях, когда в клетке слишком много глюкозо-6-фосфата.
Если бы за гексокиназой не было надзора, то слишком много глюкозы попадало бы в мышечные клетки. Они бы использовали её только для себя, а это не очень круто для организма.
Регуляция третьей реакции
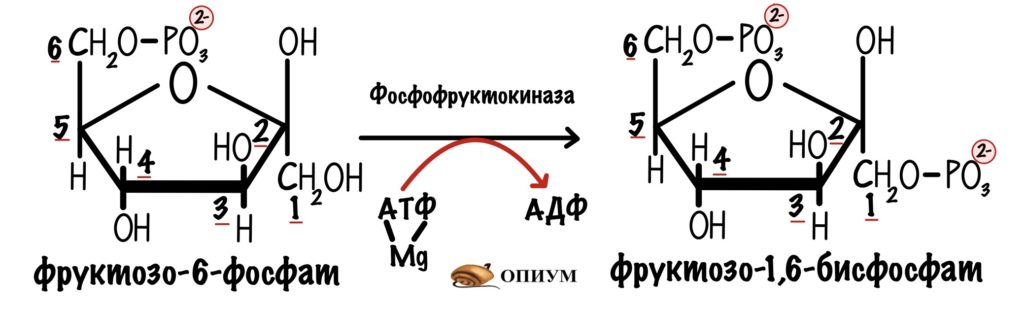
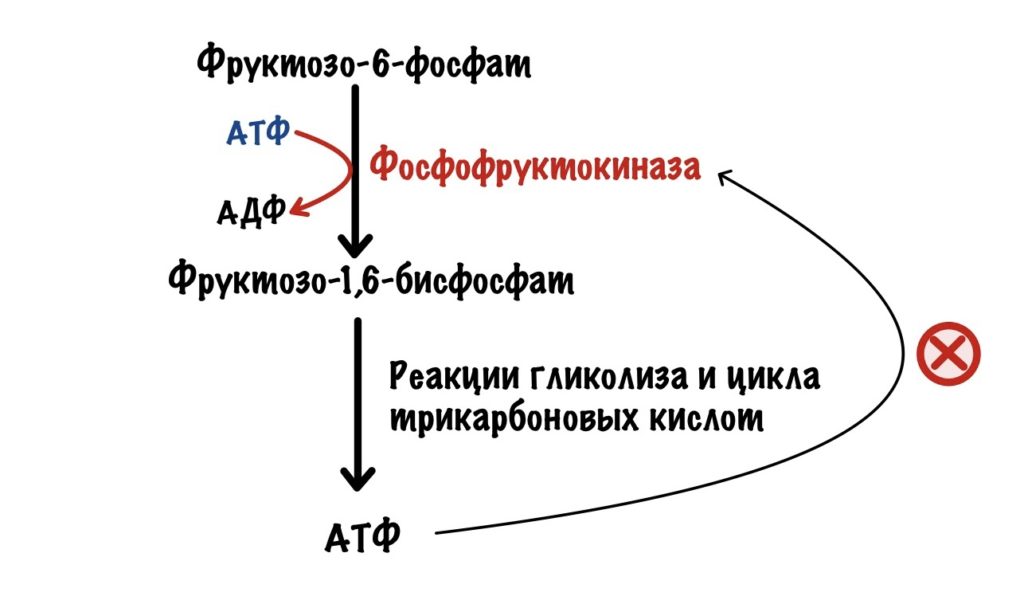
Её катализирует фосфофруктокиназа. Это ключевая реакция гликолиза, потому что она самая медленная.
Здесь гликолиз отделяется от других клеточных процессов. Ведь фруктозо-6-фосфат можно опять превратить в глюкозо-6-фосфат, а он пойдет на синтез гликогена, пентозофосфатный путь или другие процессы. Если же образовался фруктозо-1,6-бисфосфат, то это конечная. Для него есть только один путь — гликолиз.
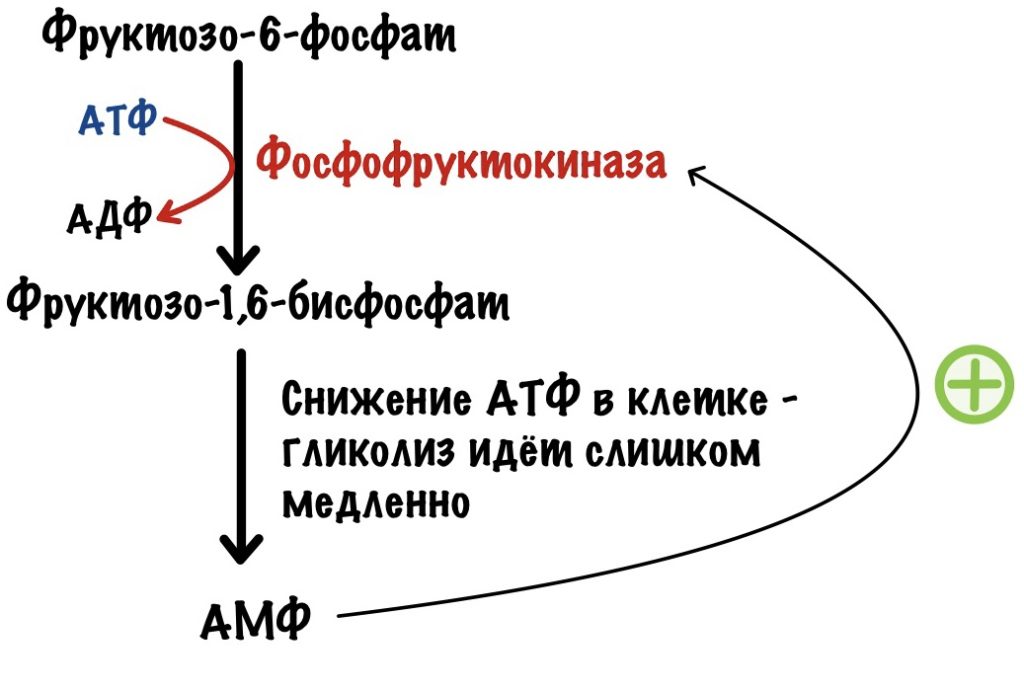
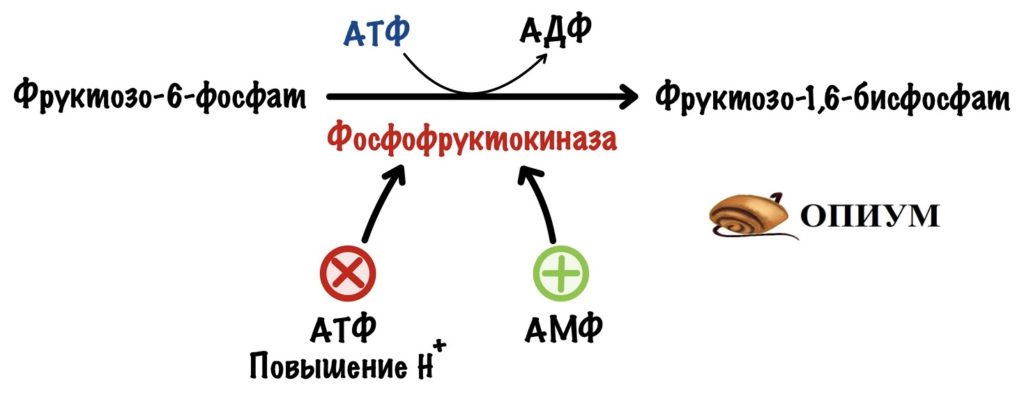
Фосфофруктокиназа регулируется клеточным соотношением АТФ к АМФ. В клетке накопилась АТФ. Значит она не идёт на полезную работу — нужно остановить гликолиз. Зачем клетке работать вхолостую?
Такая ситуация будет в мышцах, когда мы лежим и отдыхаем. Им не нужно работать, поэтому в клетке накапливается АТФ, а АМФ снижается. АТФ присоединяется к аллостерическому центру фосфофруктокиназы. Из-за этого фермент снижает свою активность — накапливается фруктозо-6-фосфат. Это отрицательная аллостерическая регуляция.
Дальше фруктозо-6-фосфат превратится в глюкозо-6-фосфат, потому что вторая реакция гликолиза обратима. Глюкозо-6-фосфат присоединится к гексокиназе — она прекратит работать. Вот такой дополнительный винтик регуляции.
Другая ситуация. В клетке растёт количество АМФ, и падает количество АТФ. Гликолиз не идёт или идёт слишком медленно. АМФ присоединяется к аллостерическому центру фосфофруктокиназы — это увеличивает её активность. АМФ говорит клетке: «Пора работать, нам не хватает энергии!». Это положительная аллостерическая регуляция.
Такая ситуация будет в мышцах, когда мы начинаем двигаться. Им нужно поработать, поэтому время запустить гликолиз или увеличить его активность.
Откуда берётся АМФ?
АМФ появляется в клетке при реакции двух АДФ. Под действием аденилаткиназы они превращаются в молекулу АТФ и АМФ. АТФ идёт на мышечные сокращения, а АМФ используется как аллостерический регулятор для ферментов.
Фосфофруктокиназа чувствительна к изменениям клеточных условий. Она выключается при закислении среды — при росте протонов водорода. Низкий pH, кислотный, опасен для клетки — это приведёт к её повреждению.
Регуляция десятой реакции
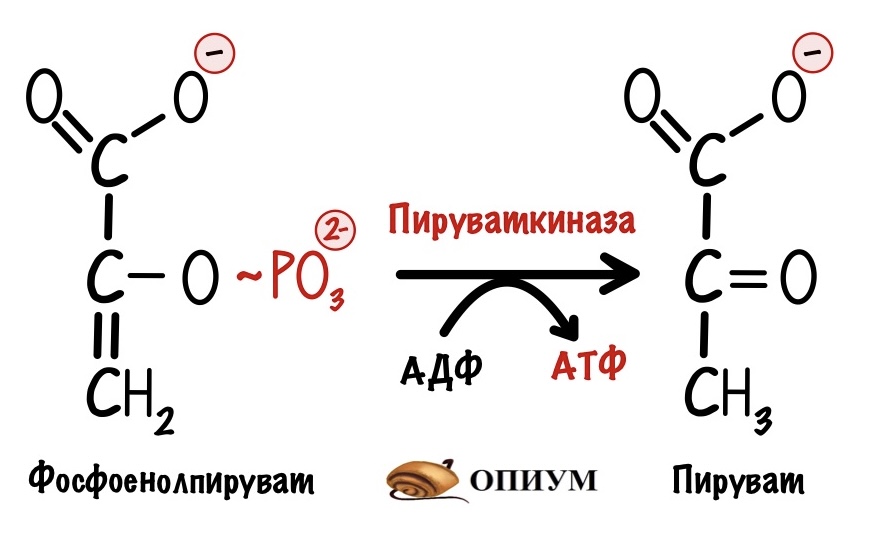
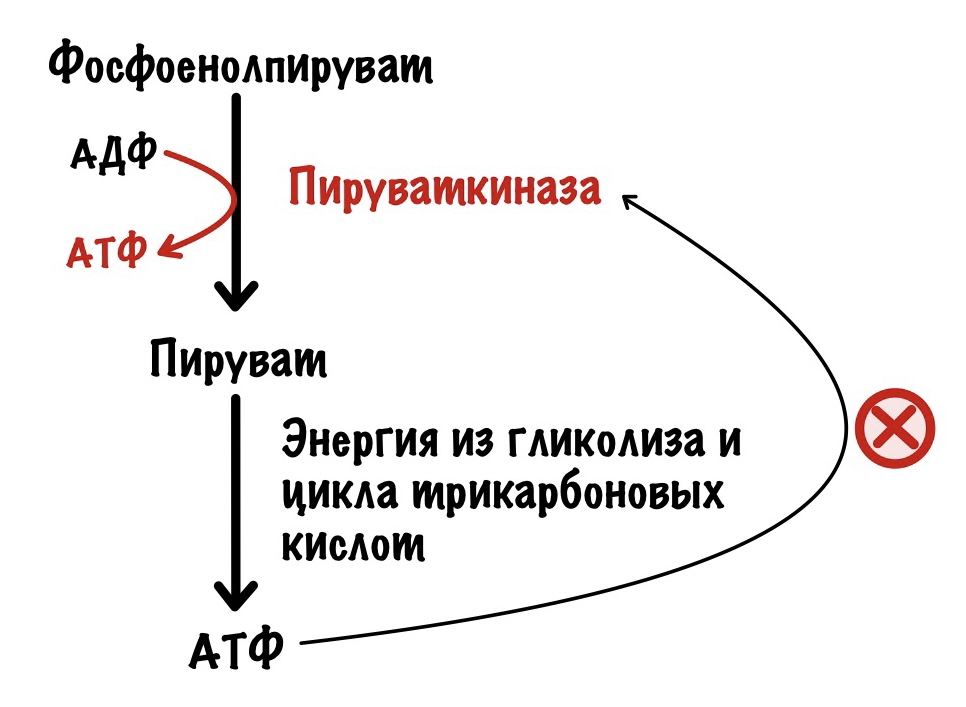
Превращение фосфоенолпирувата в пируват. Фермент — пируваткиназа.
Пируваткиназа тоже регулируется аллостерически. При повышении уровня АТФ в клетке она связывается с аллостерическим центром пируваткиназы. Это приводит к её ингибированию.
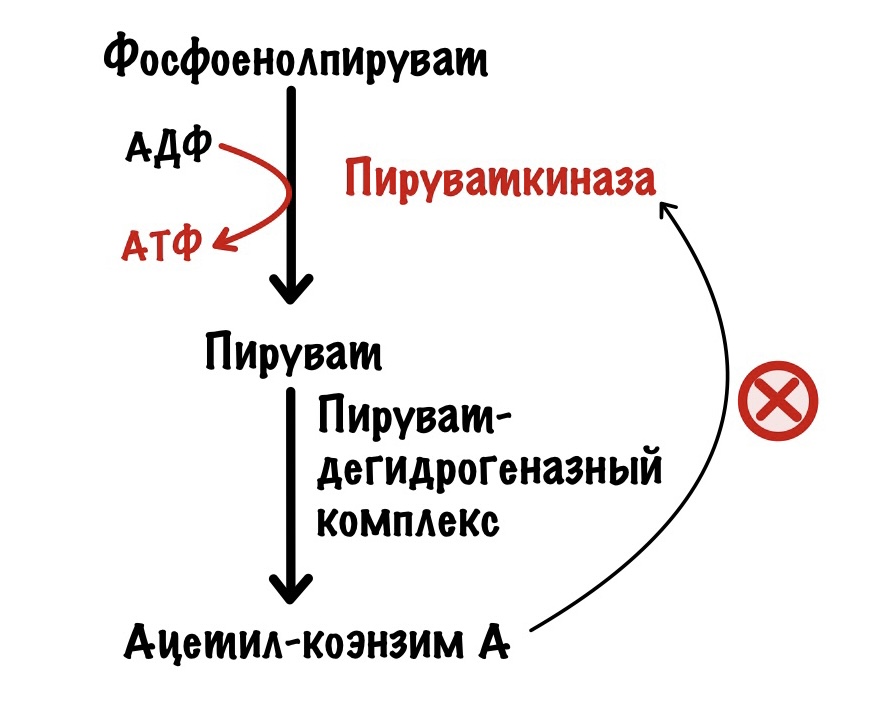
Для того, чтобы вступить в цикл трикарбоновых кислот (ЦТК) пируват должен превратиться в ацетил-коэнзим А. Эту реакцию катализирует пируватдегидрогеназный комплекс. Если в клетке слишком много АТФ, то ЦТК ингибируется — это приводит к накоплению ацетил-конэзима А. Ацетил-коэнзим А аллостерически блокирует активность пируваткиназы. Ещё ацетил-коэнзим А блокирует пируватдегидрогеназный комплекс, но об этом в другой раз.
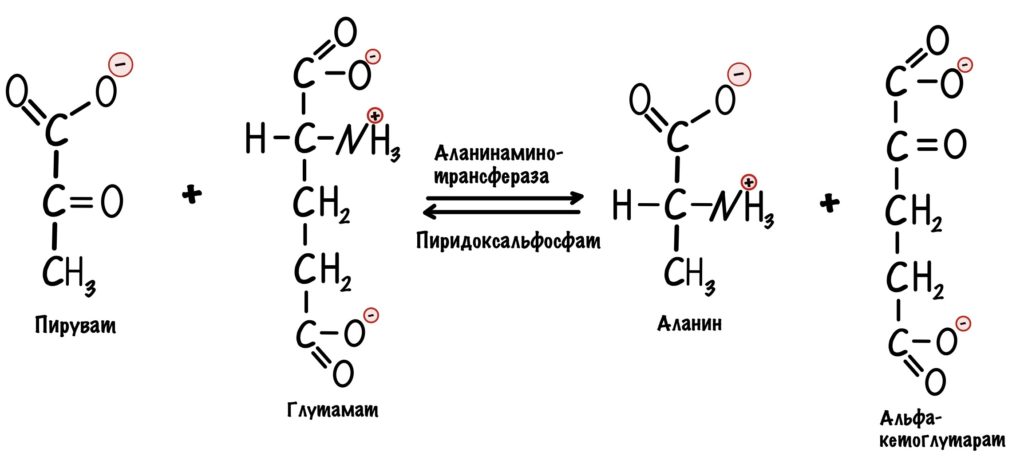
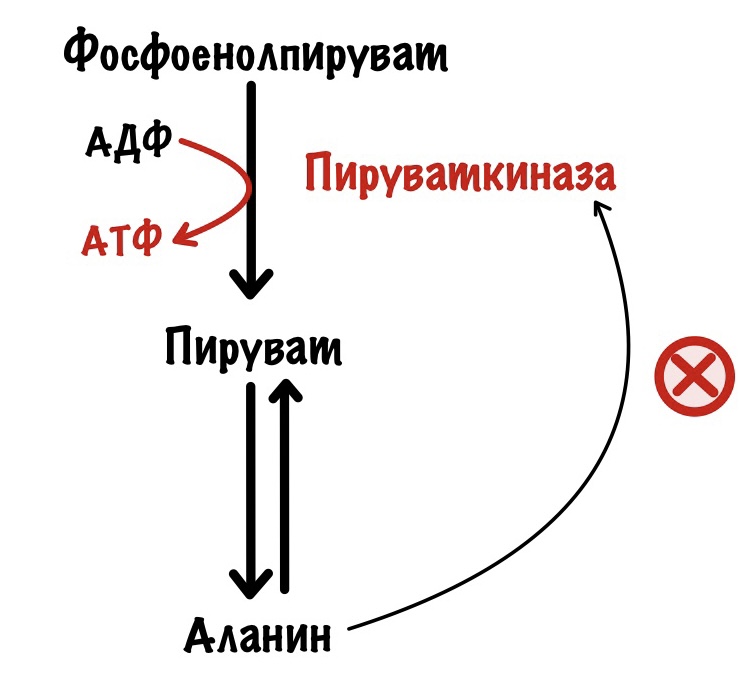
Но пируват идёт не только в цикл трикарбоновых кислот, но может использоваться для синтеза аминокислот. Из него образуется аланин с помощью реакции трансаминирования.
Поэтому аланин также отрицательный аллостерический регулятор для пируваткиназы.
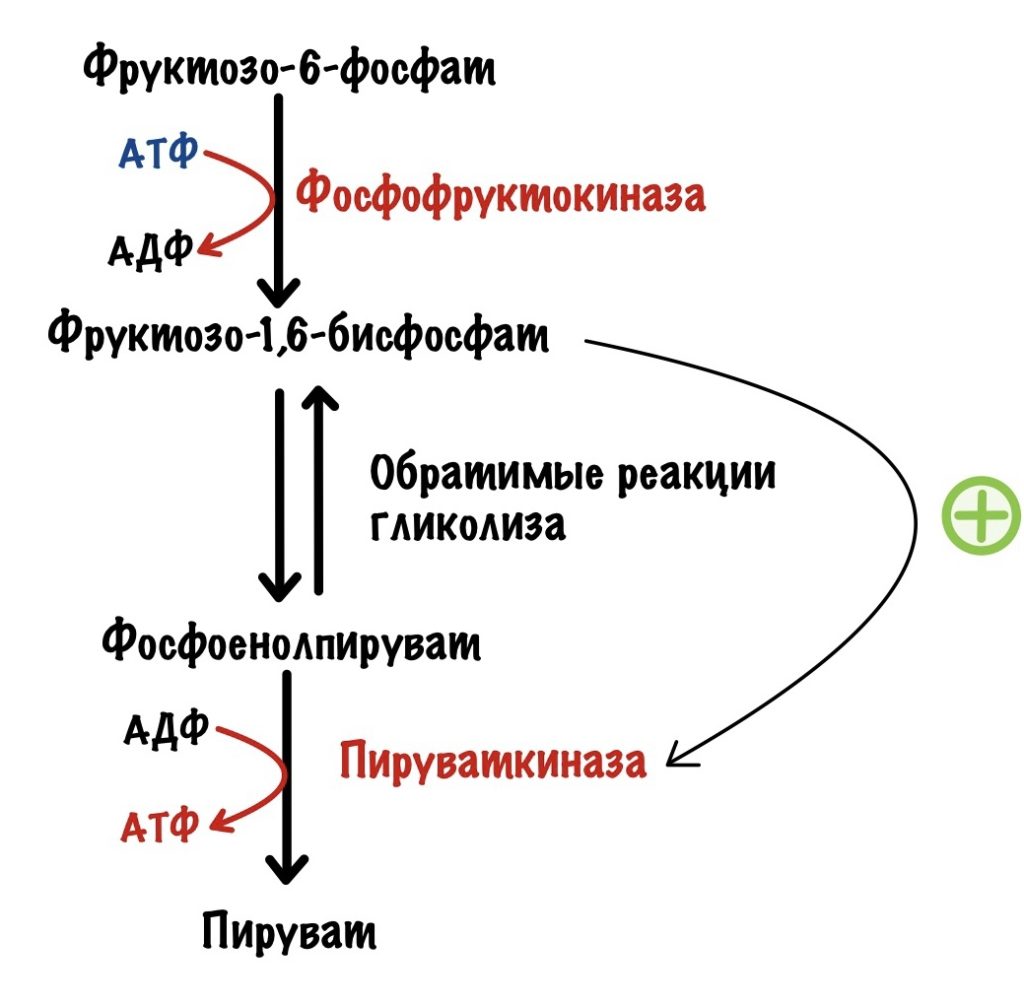
Но есть и положительный регулятор. Продукт третьей реакции — фруктозо-1,6-бисфосфат. Он повышает активность пируваткиназы.
У мышц нет быстрой гормональной регуляции. Я сейчас говорю только о гликолизе!!! Гормоны не фосфорилируют или дефосфорилируют ферменты гликолиза в мышцах. Но есть медленная регуляция — экспрессия или репрессия генов, кодирующих ферменты. Об этом поговорим ниже. Вот сводная картинка по регуляции гликолиза в мышцах:
В принципе, мы можем сделать вывод, что основной способ регуляции в мышцах — аллостерический. Для мышц наибольшее значение имеет изменение энергетического баланса в клетке — соотношение АТФ к АМФ.
Аллостерическая регуляция гликолиза и глюконеогенеза в печени
Печень не похожа на мышцы. Она альтруистка. В ней запасается гликоген, который разрушается между приёмами пищи. Глюкоза, образовавшаяся при этом, выбрасывается в кровь, а не идёт на гликолиз. Оттуда большая часть глюкозы попадёт в мозг — главный глюкозный наркоман. Другим тканям тоже достанется, но поменьше.
Поэтому печень старается беречь глюкозу, а не пускать её на гликолиз когда попало. В ней гликолиз идёт только после приёмов пищи, когда концентрация глюкозы огромна. Для этого клетка использует более сложные механизмы, чем в мышцах. Давайте посмотрим на них.
Регуляция первой реакции
Её катализирует глюкокиназа. Это изофермент гексокиназы. Они выполняют сходную функцию, но кодируются разными генами. Отсюда различия в их белковой структуре и константе Михаэлиса-Ментена.
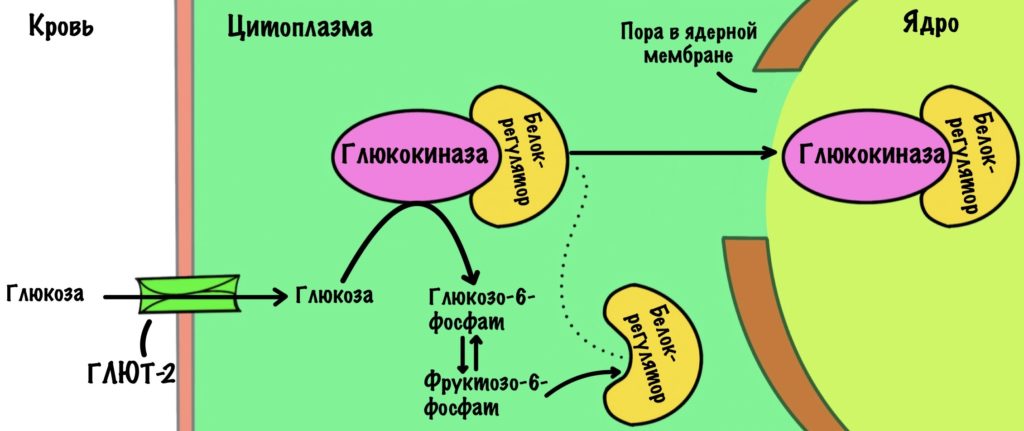
Глюкокиназа имеет константу Михаэлиса-Ментена 10 ммоль/л. Сродство к глюкозе у глюкокиназы меньше, чем у гексокиназы. Она будет активна при высокой концентрации глюкозы в клетке. Такая концентрация создаётся после приёмов пищи. Ещё нужно вспомнить, что в цитоплазматической мембране печени находятся глюкозные транспортеры второго типа (ГЛЮТ-2). Они переносят глюкозу внутрь клетки только при её высокой концентрации в крови. Когда концентрация глюкозы падает, то ГЛЮТ-2 выбрасывает глюкозу из клетки — переносчик работает в обе стороны.
Но у глюкокиназы есть плюс — она не ингибируется глюкозо-6-фосфатом. Почему?
Глюкозо-6-фосфат используется не только для гликолиза, но и для других процессов. Например, пентозофосфатный путь, синтез гликогена и жирных кислот. Клетка пытается по максимуму перевести глюкозу в глюкозо-6-фосфат, а потом использовать его для своих нужд. Она создаёт запас энергии в виде гликогена и жиров. Но не только для себя, как в мышцах, а для всего организма. Если бы глюкозо-6-фосфат ингибировал эту реакцию, то ничего хорошего не вышло. Гликолиз и пентозофосфатный путь дают начальные субстраты для синтеза жирных кислот. Гликолиз поставляет пируват, который потом превратится в ацетил-коэнзим А. А пентозофосфатный путь — НАДФH.
Когда концентрация глюкозы в клетке маленькая, то глюкокиназа неактивна — у неё маленькое сродство ( слишком большая константа Михаэлиса-Ментена). Это гарантирует, что глюкоза попадёт в кровь — через ГЛЮТ-2 типа. А не будет фосфорилирована клеткой. Потом она отправится в мозг, для которого глюкоза почти единственный энергетический субстрат. Эритроциты тоже любят глюкозу, но сдаётся мне, что мозг поважнее.
Всё-таки для глюкокиназы существует регулятор — с помощью него клетка перестраховывается. Этот регулятор — белок, который активируется при избытке фруктозо-6-фосфата. Белок связывается с глюкокиназой и затаскивает её в ядро.
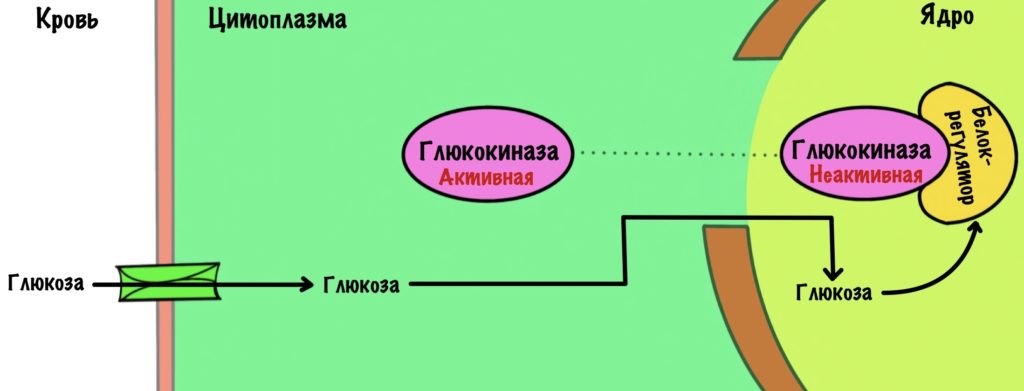
Белок-регулятор может связываться и с глюкозой. Когда концентрация глюкозы в крови растёт, то она проникает в клетку, а потом и в ядро. Там она связывается с белком, и он выпускает глюкокиназу из своих лап. Она возвращается в цитоплазму и начинает пахать.
Этот механизм важен при снижении глюкозы в крови — так печень не будет конкурировать за потребление глюкозы с другими тканями. Но после приёма пищи — ух глюкоза, держись!
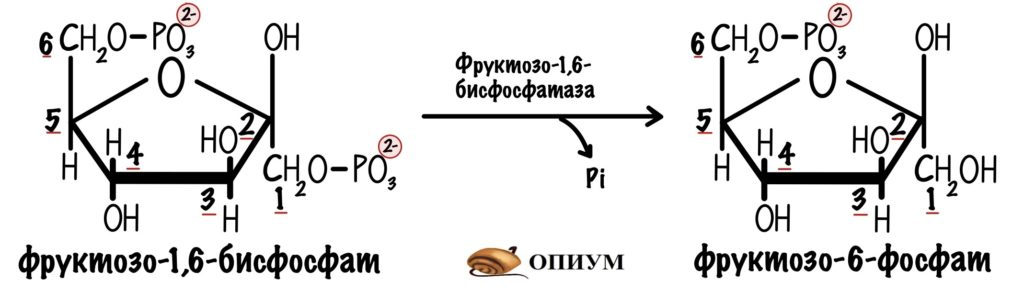
Но мы всё про гликолиз, а что с глюконеогенезом? Превращение глюкозо-6-фосфата в глюкозу катализирует глюкозо-6-фосфатаза. Но сказать про неё здесь ничего не могу — нет аллостерической регуляции. Для глюкозо-6-фосфатазы есть гормональная регуляция, но поговорим о ней позже. На этом этапе достаточно остановить реакции гликолиза для того, чтобы запустить глюконеогенез.
Регуляция третьей реакции и её обходного пути
Превращение фруктозо-6-фосфата в фруктозо-1,6-фосфат в гликолизе. Катализирует реакцию фосфофруктокиназа.
И превращение фруктозо-1,6-бисфосфата в фруктозо-6-фосфат в глюконеогенезе. Катализирует реакцию фруктозо-1,6-бисфосфатаза.
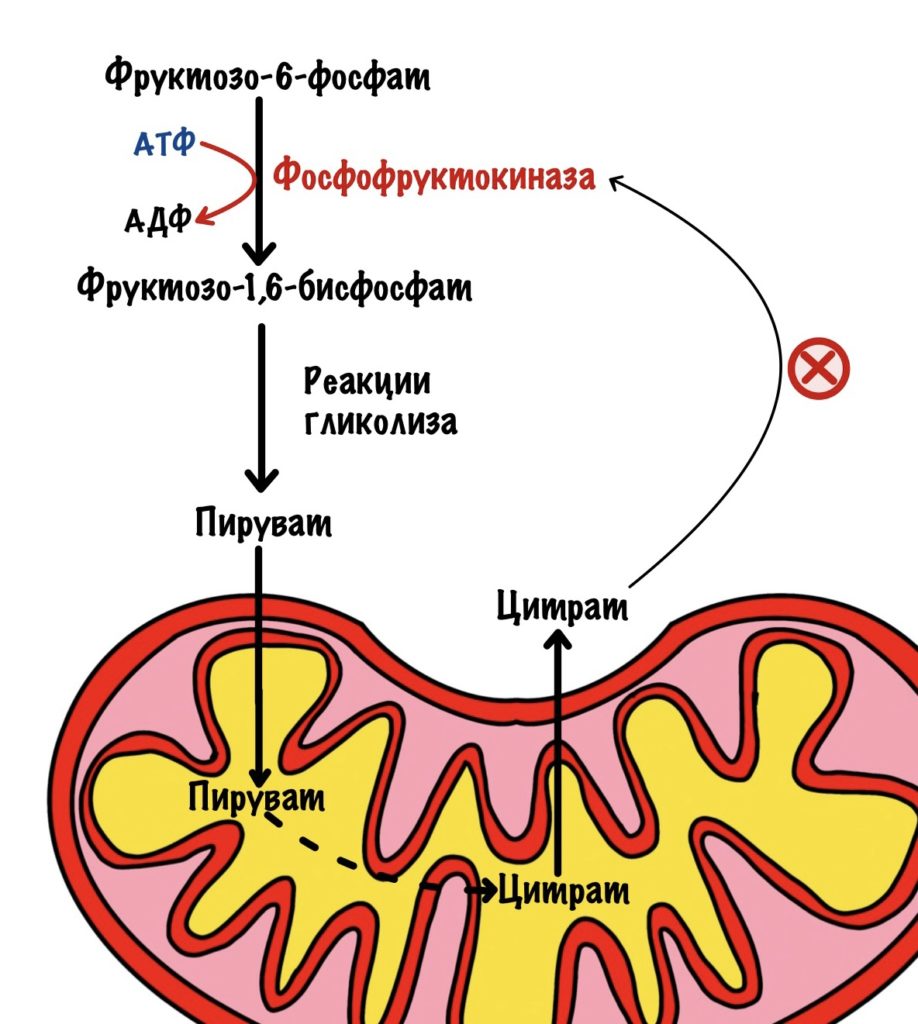
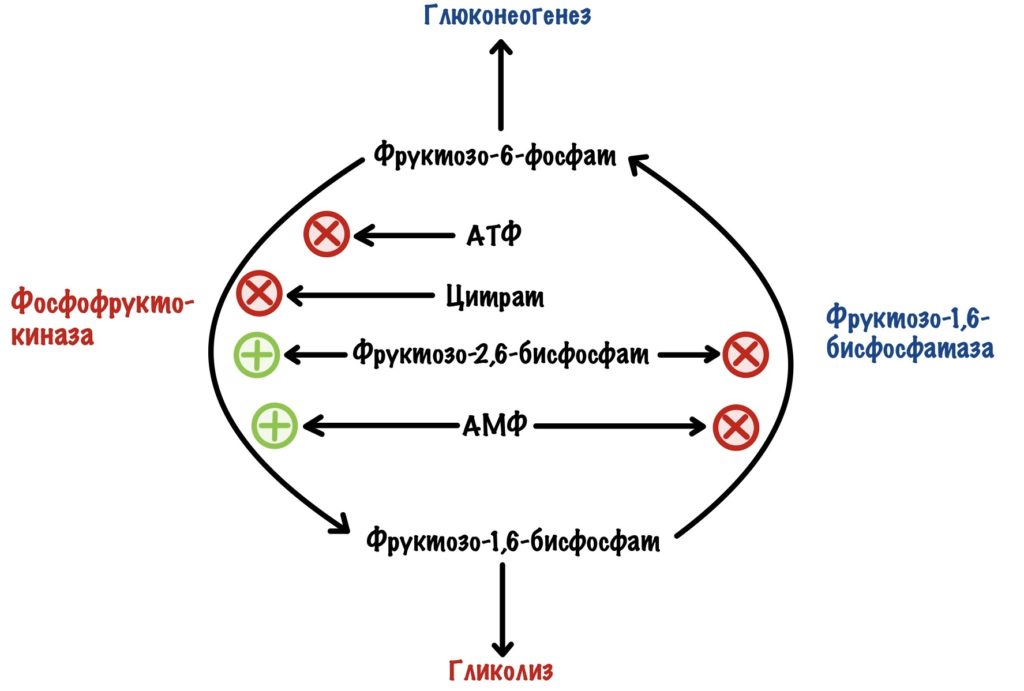
Фосфофруктокиназа печени тоже чувствительна к соотношению АТФ к АМФ, как и в мышцах. Если в клетке повысится концентрация АТФ, то он ингибирует фосфофруктокиназу — накапливается фруктозо-6-фосфат. Фруктоза-6-фосфат активирует белок-ингибитор глюкокиназы, а дальше вы уже знаете.
Но есть и другой механизм. Когда пируват попадёт митохондрию, то из него синтезируется ацетил-коэнзим А. Он попадает в цикл трикарбоновых кислот (ЦТК), где из него образуется цитрат. ЦТК используется для синтеза АТФ, когда концентрация АТФ в митохондрии большая, то он останавливается. Цитрат накапливается в митохондрии. Оттуда он может попасть в цитоплазму и ингибировать активность фосфофруктокиназы.
Эти механизмы ингибирования включаются после приёма пищи. В печень через воротную вену попадёт много глюкозы из ЖКТ. Часть из неё пойдет в гликолиз для синтеза АТФ. Когда клетка утолит свои энергетические потребности, то концентрация АТФ и цитрата возрастёт. Они блокируют фосфофруктокиназу. Из фруктозо-6-фосфата получим глюкозо-6-фосфат, который пойдёт на синтез гликогена или другие процессы.
Но для фосфофруктокиназы существуют и положительные регуляторы. Также, как и в мышцах, она активируется АМФ. Но этот регулятор не так важен, как второй — фруктозо-2,6-бисфосфат. Проблема в том, что фосфофруктокиназа практически не активируется АМФ при клеточных условиях, если нет фруктозо-2,6-бисфосфата. Фруктозо-2,6-бисфосфат влияет не только на фосфофруктокиназу. Он отрицательный аллостерический регулятор для фруктозо-1,6-бисфосфатазы, фермента глюконеогенеза. АМФ, кстати, тоже. Вот реципрокная регуляция во всей красе.
Фруктоза-2,6-бисфосфат активирует гликолиз, но ингибирует глюконеогенез.
Но откуда он вообще взялся? Мы ещё не встречались с этой молекулой. Время знакомиться.
Синтез и распад фруктозо-2,6-бисфосфата под гормональным контролем и не только
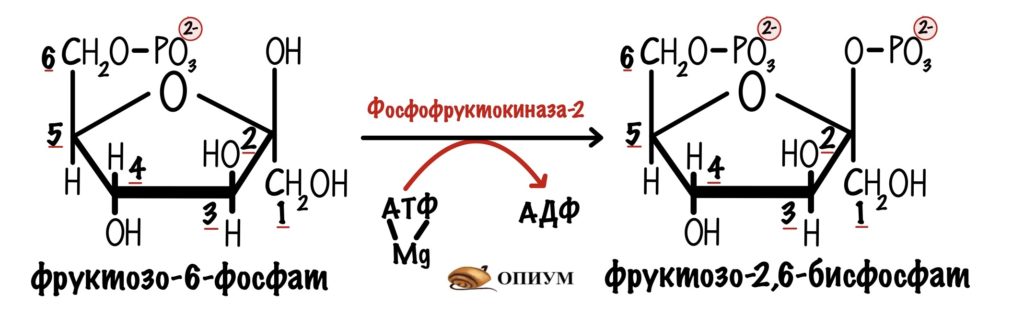
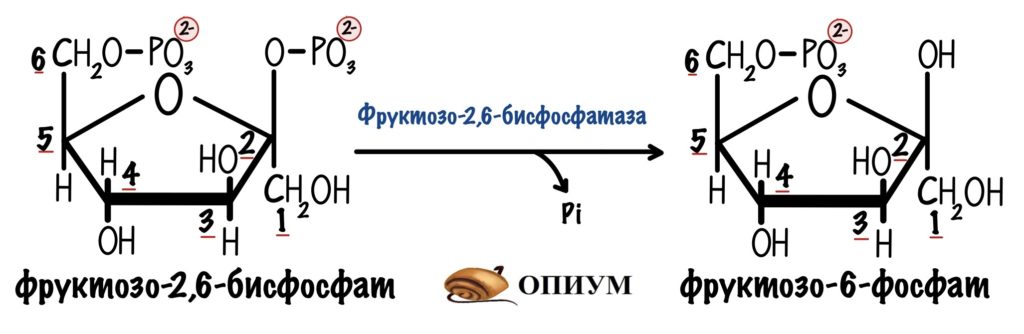
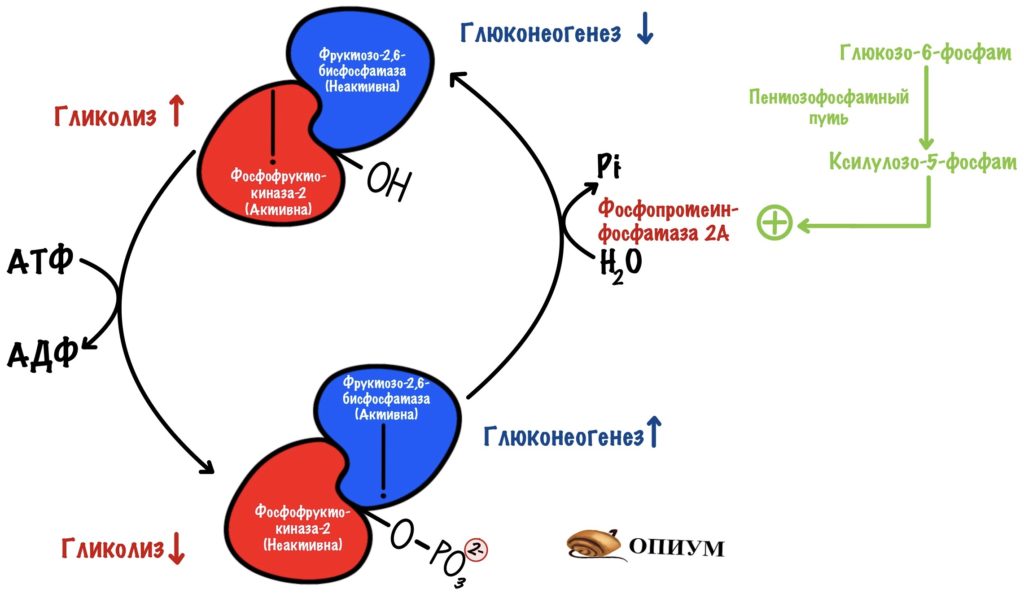
Фруктозо-2,6-бисфосфат синтезируется из фруктозо-6-фосфата. Удивил? Эту реакцию катализирует фермент фосфофруктокиназа-2. Изофермент фосфофруктокиназы из гликолиза. Только она присоединяет фосфорную группу во втором положении, а не первом.
Есть и обратная реакция разрушения фруктозо-2,6-бисфосфата. Эту реакцию катализирует фруктозо-2,6-бисфосфатаза. А это уже изофермент фруктозо-1,6-бисфосфатазы.
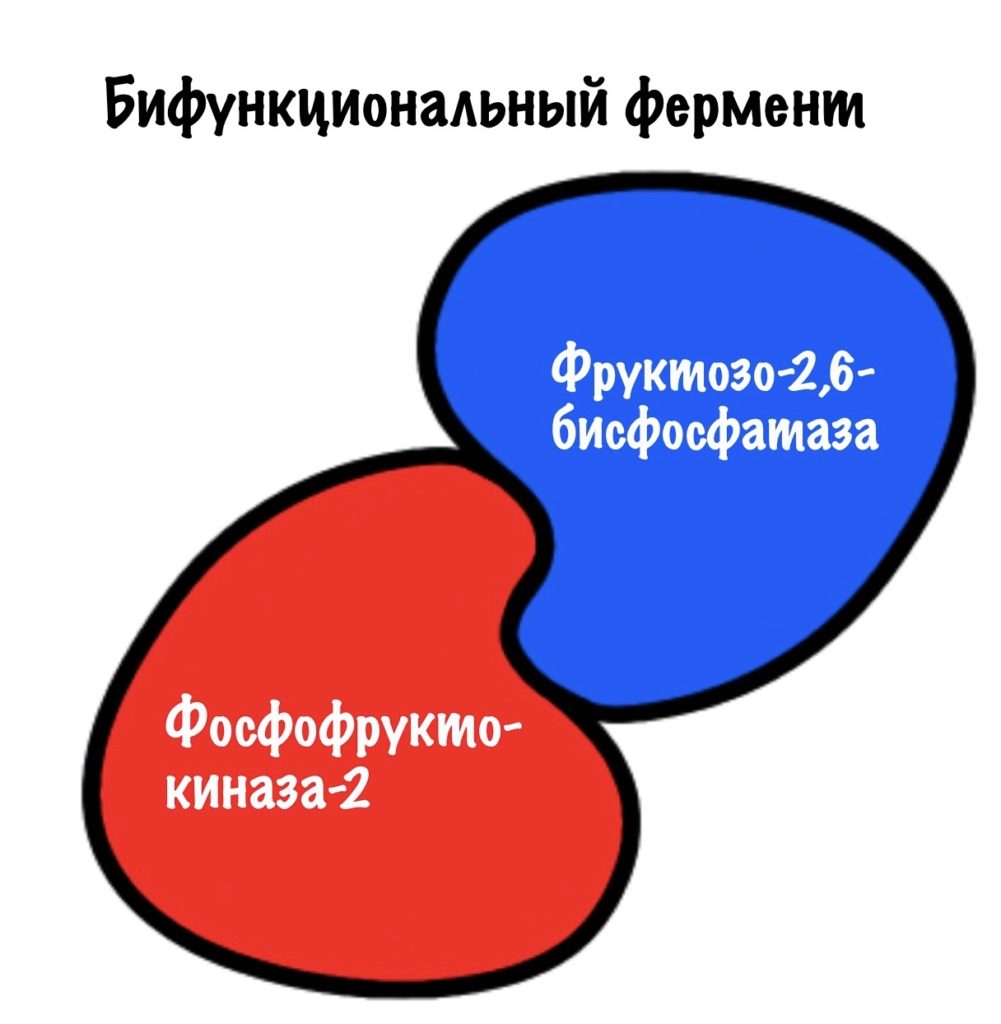
Но это ещё не все приколы! Эти два фермента на самом деле один белок. И называют его бифункциональный белок. У него две каталитические субъединицы: одна ответственна за фосфорилирование, а другая за дефосфорилирование.
Получается, что для грамотной работы этого механизма нужно, чтобы в одно время работала только одна субъединица. Либо фосфорилируй, либо дефосфорилируй. А то получится какая-то каша. Поэтому этот белок находится под гормональным контролем. И контроль должен быть быстрым, не будет же клетка ждать, пока там насинтезируются новые белки. Или, наоборот, разрушатся старые. Это можно сделать через фосфорилирование/дефосфорилирование.
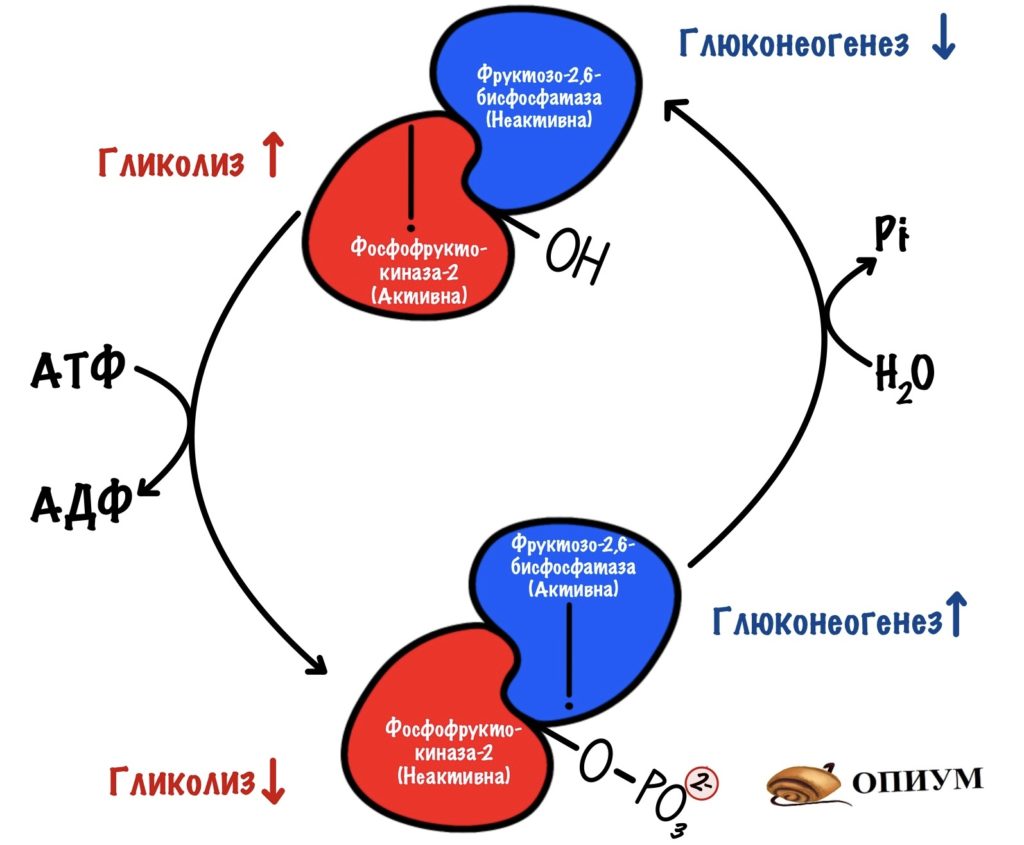
В фосфорилированной форме работает фруктозо-2,6-бисфосфатаза. А в дефосфорилированной — фосфофруктокиназа-2. Ну а теперь время вспомнить сигнальные молекулы)))
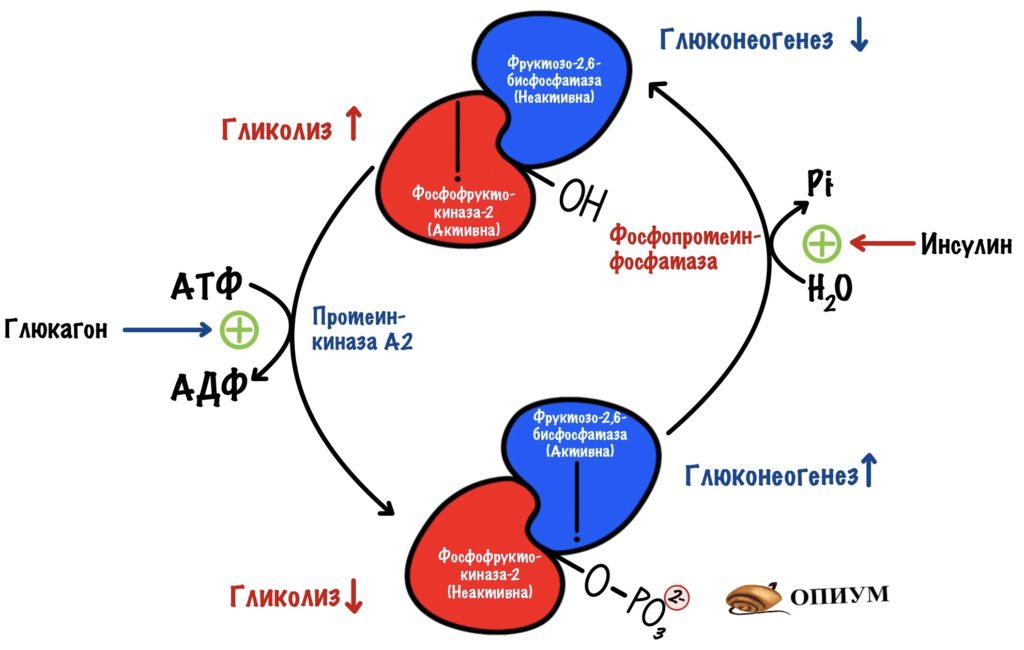
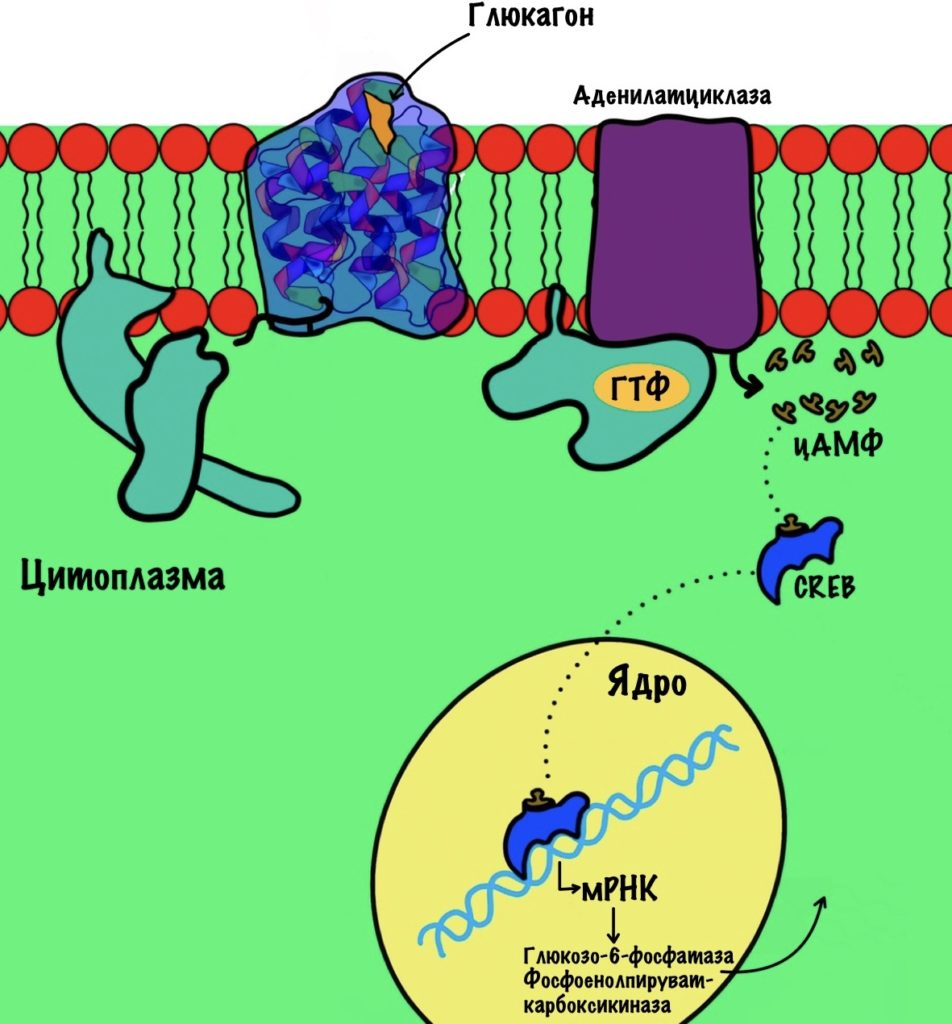
Активация фруктозо-2,6-бисфосфатазы идёт через аденилатциклазную систему (подробнее про неё здесь). Её включает глюкагон. Глюкагон увеличивает образование вторичного мессенджера — цАМФ. цАМФ присоединяется к протеинкиназе А2, которая начинает фосфорилировать белки. Один из этих белков — бифункциональный.
Из-за этого снижается концентрация фруктозо-2,6-фосфата. Без него активируется фруктозо-1,6-бисфосфатаза, но ингибируется фосфофруктокиназа. Получается, что глюкагон активирует глюконеогенез. При этом отключается гликолиз.
Активация фосфофруктокиназы-2 идёт через инсулиновый рецептор (подробнее про него). Инсулин активирует фосфопротеинфосфатазу, которая занимается дефосфорилированием белков. Она дефосфорилирует наш бифункциональный белок. Возрастает активность фосфофруктокиназы-2 — увеличивается концентрация фруктозо-2,6-бисфосфата. Фруктозо-2,6-бисфосфат активирует фосфофруктокиназу, но отключает фруктозо-1,6-бисфосфатазу. Получается, что инсулин активирует гликолиз в печени, но при этом отключает глюконеогенез.
Глюкагон действует между приёмами пищи. Поэтому он блокирует гликолиз, чтобы печень не истратила всю глюкозу на себя. При этом активируется глюконеогенез — увеличивается поступление глюкозы в кровь.
Инсулин действует после того, как мы покушали. Он активирует гликолиз, чтобы печень могла синтезировать себе молекул АТФ. При этом глюконеогенез не нужен — в крови и так много глюкозы.
Ксилулозо-5-фосфат изменяет активность бифункционального фермента
Не пугаемся этой молекулы! Ксилулозо-5-фосфат образуется в пентозофосфатном пути. Помните в начале статьи мы говорили о том, что часть глюкозы в печени идёт на пентозофосфатный путь? Это происходит, когда концентрация глюкозы в крови большая. Так вот, в ходе него синтезируется ксилулозо-5-фосфат. Эта молекула активирует другую фосфопротеинфосфатазу — 2А. Она также дефосфорилирует бифункциональный фермент. А значит — увеличивает его фосфофруктокиназную активность. Образуется фруктозо-2,6-фосфат, который включает гликолиз, но выключает глюконеогенез. Так что ксилулозо-5-фосфат по своему действию похож на инсулин.
Регуляция десятой реакции и её обходного пути
В гликолизе эту реакцию катализирует пируваткиназа — превращение фосфоенолпирувата в пируват.
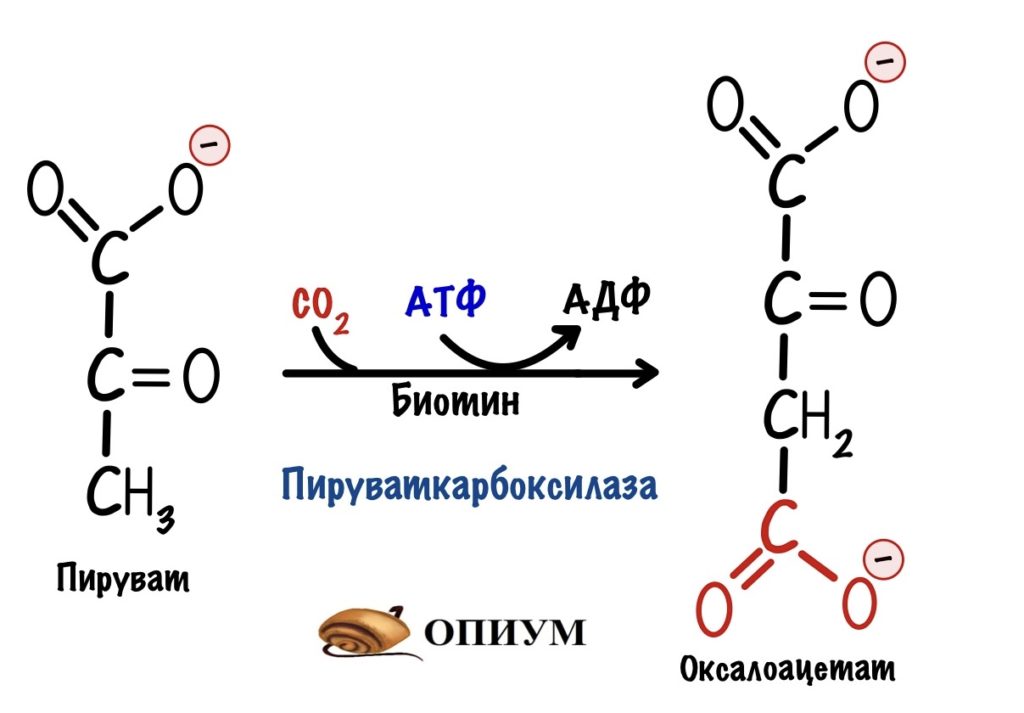
А в глюконеогенезе она разделена на две. На первом этапе из пирувата образуется оксалоацетат. Катализатор — пируваткарбоксилаза.
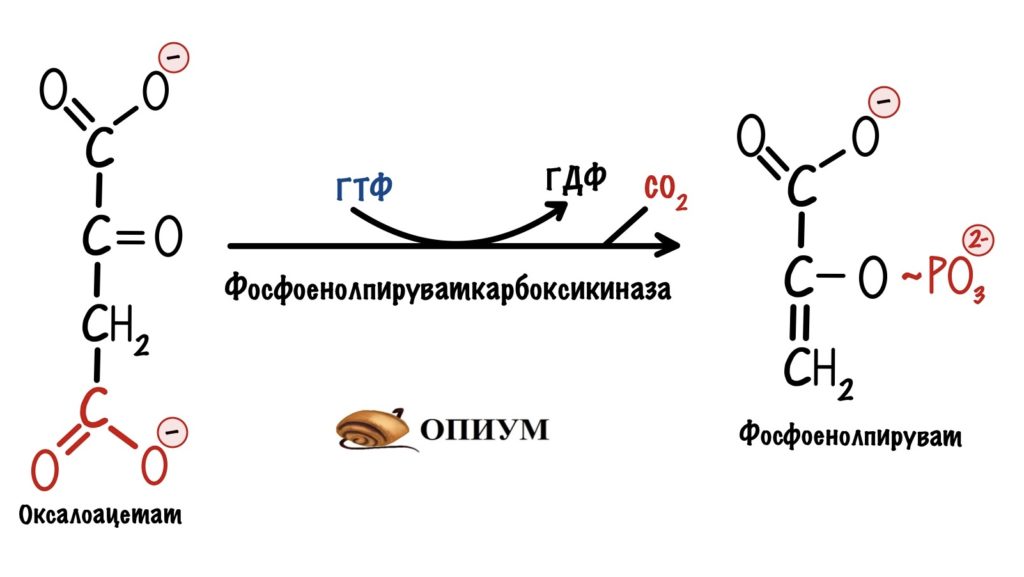
На втором этапе из оксалоацетата образуется фосфоенолпируват. Фермент — фосфоенолпируваткарбоксикиназа.
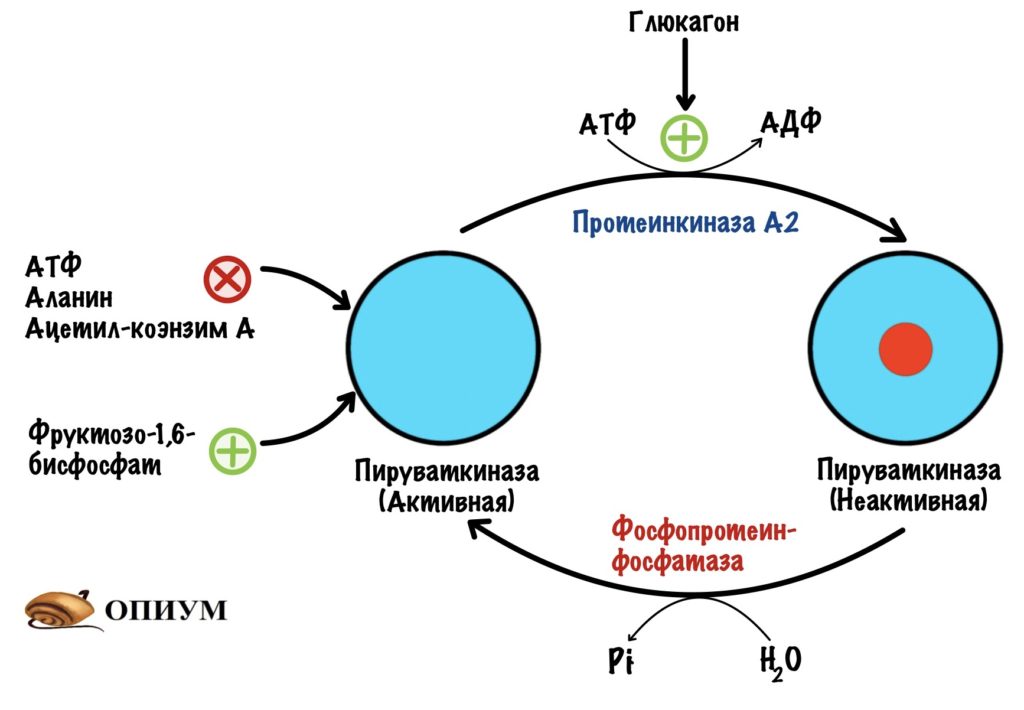
Пируваткиназа в печени тоже ингибируется избытком АТФ, аланина и ацетил-коэнзима А. Активируется под действием фруктозо-1,6-фосфата. В общем-то всё как и в мышцах. Но это опять-таки изоферменты, поэтому есть свои особенности.
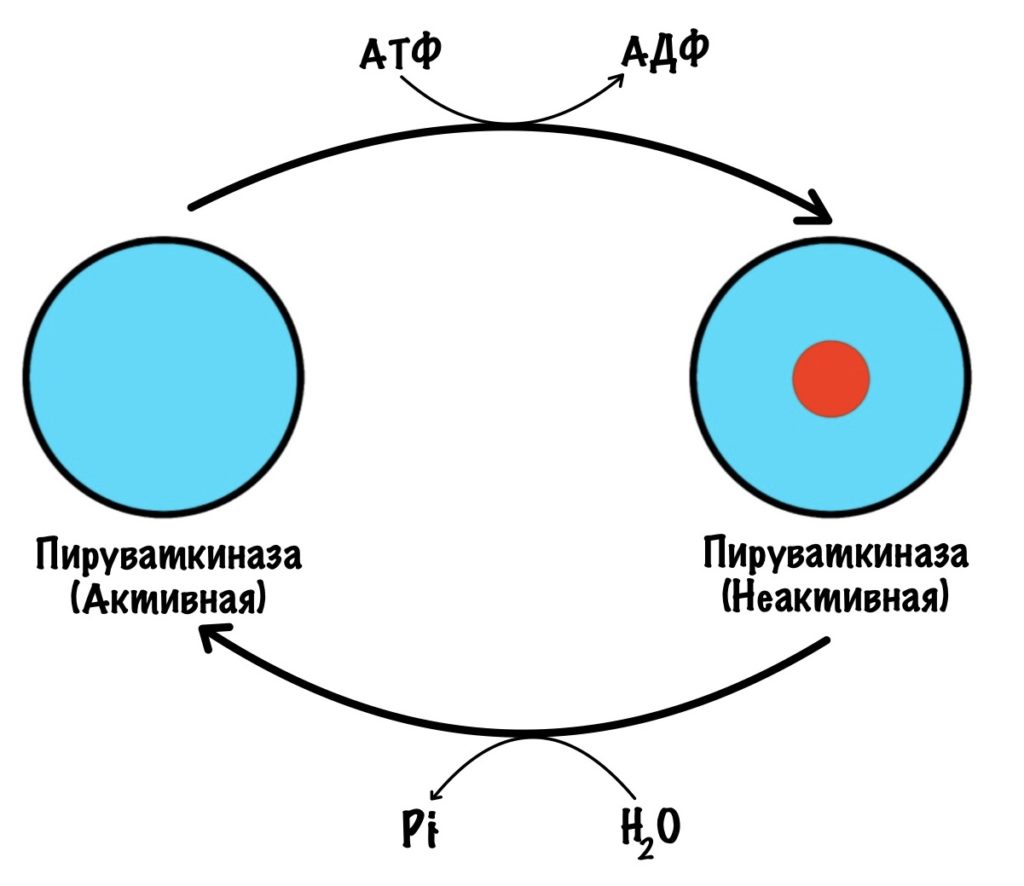
В печени пируваткиназа находится под гормональным контролем. Пируваткиназа активна в дефосфорилрованной форме, а не активна в фосфорилированной.
Глюкагон активирует аденилатциклазную систему — включается протеинкиназа А2, что приводит к фосфорилированию пируваткиназы. Она становится неактивной. И правильно, нечего печени использовать глюкозу, которая предназначена для других тканей. Когда концентрация глюкагона в крови падает, то он перестаёт фосфорилировать пируваткиназу. В клетке начинают действовать фосфопротеинофосфатазы, которые переводят пируваткиназу в активную форму.
Снова убеждаемся, что печень — альтруистка. Между приёмами пищи она не даёт идти гликолизу, а отправляет глюкозу в кровь. Только после того, как мы покушали, она может насладиться глюкозкой.
Пируваткарбоксилаза. Из двух обходных реакций нас интересует только одна — первая. Превращение пирувата в оксалоацетат. Положительный регулятор для пируваткарбоксилазы — ацетил-коэнзим А. Повторим, откуда он берётся. В ходе гликолиза образуется пируват, который под действием пируватдегидрогеназного комплекса превращается в ацетил-коэнзим А. Эта реакция идёт в митохондрии. Если происходит накопление ацетил-коэнзима А, то он блокирует пируватдегидрогеназный комплекс и пируваткиназу. Но при этом активирует глюконеогенез — через активацию пируваткарбоксилазы.
Медленная гормональная регуляция и кое-что ещё
Осталось разобраться с последним — экспрессией и репрессией генов, кодирующих ферменты гликолиза и глюконеогенеза. То есть будем менять не активность ферментов, а их количество. Это происходит не быстро, как в аллостерической регуляции и фосфорилировании/дефосфорилировании. Эта регуляция занимает сутки, а то и больше. Синтез ферментов — длительный процесс.
Гормоны делают это по двум механизмам: через изменение активности факторов транскрипции или присоединение к ядерному рецептору. По первому механизму работают водорастворимые гормоны — в этой статье речь пойдет об инсулине и глюкагоне. По второму механизму действуют жирорастворимые гормоны — глюкокортикостероиды.
Факторы транскрипции — это белки, которые присоединяются к ДНК в определённых местах. Они контролируют синтез матричной РНК, с помощью которой потом будет синтезированы белки-ферменты.
Инсулин
Снова вспоминаем действие инсулина на клетку. Оно идёт по двум путям: активация протеинкиназы B и действие на факторы роста (ERK-1) через MEK-киназу. Второй путь направлен на ядро — синтез белков и ферментов, которые нужны для роста и деления клетки. Но и протеинкиназа B действует на факторы транскрипции, например она фосфорилирует PDX1, который ответственен за синтез ферментов метаболизма углеводов и жиров. Почитать про это подробнее можно здесь.
Вот какое действие у инсулина на синтез ферментов гликолиза и глюконеогенеза:


Чуть дальше мы увидим, через какие дополнительные факторы транскрипции он это делает.
Делаем вывод: инсулин увеличивает синтез ферментов гликолиза. При этом подавляется синтез ферментов глюконеогенеза. Ну и правильно, если инсулин действует на клетку, то глюкозы в крови полно.
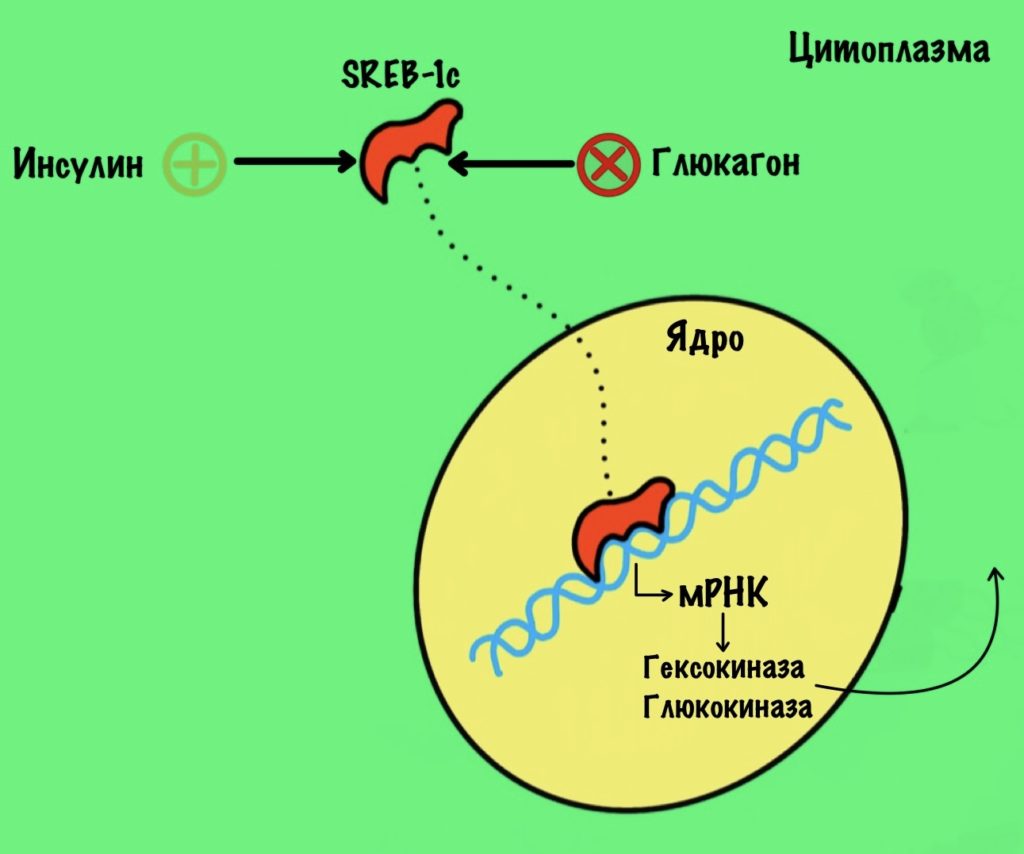
SREB-1c
У всех этих факторов такие сложные названия, жуть просто. Эта аббревиатура расшифровывается так — sterol regulatory element binding proteins. Если на русском, то белки, связывающие регуляторный элемент стирола. Мрак. Пацаны, успокойтесь — это можно не учить, наверное. Я просто хочу показать насколько сложно контролируется синтез этих ферментов.
Этот фактор транскрипции увеличивает синтез гексокиназы и глюкокиназы. При этом он подавляет синтез глюкозо-6-фосфатазы, фруктозо-1,6-бисфосфатазы и фосфоенолпируваткарбоксикиназы. Получается, он увеличивает синтез ферментов гликолиза, но при этом подавляет синтез ферментов глюконеогенеза. Этот фактор стимулируется инсулином. А подавляется глюкагоном. Ну не прямо ими, а через их эффекты на рецептор.
CREB
Или cyclic AMP response element binding protein. А ещё лучше так — белок, связывающий элемент ответа цАМФ. Такое ощущение, что эти факторы лучше не переводить.
CREB увеличивает синтез глюкозо-6-фосфатазы и фосфоенолпируваткарбоксилазы. Концентрация цАМФ увеличивается при действии глюкагона (активирует аденилатциклазную систему). ЦАМФ связывается с этим протеином, который вызывает экспрессию генов.
FOXO1
Forkhead box protein O1. Обойдёмся без перевода. FOXO1 связан с ДНК. Он вызывает экспрессию генов, кодирующих глюкозо-6-фосфатазу и фосфоенолпируваткарбоксилазу. При действии инсулина этот фактор отсоединяется от ДНК и попадает в цитоплазму. Там его фосфорилирует протеинкиназа B. Из-за этого FOXO1 становится неактивным. После этого этот фактор разрушается в протеасоме. Грустно и невкусно.
Глюкагон предотвращает действие инсулина на FOXO1. Но стоит ему зазеваться и больше нет фактора транскрипции…
ChREPB
Carbohydrate response element binding protein — углевод-реагирующий элемент-связывающий белок. Этот фактор транскрипции контролирует синтез ферментов, которые ответственны за синтез углеводов и жиров. Между приёмами пищи этот фактор неактивен. Он фосфорилирован и находится в цитоплазме. Всё меняется после приёма пищи. В клетке начинается пентозофосфатный путь, где синтезируется ксилулозо-5-фосфат (опять!). Ксилулозо-5-фосфат активирует фосфопротеинфосфатазу 2A, которая дефосфорилирует ChREPB. Он попадает в ядро, где происходит его второе дефосфорилирование. Опять же с помощью фосфопротеинфосфатазы 2A. После этого он присоединяется к ДНК и индуцирует синтез ферментов. Каких? Гликолиза и синтеза жиров.
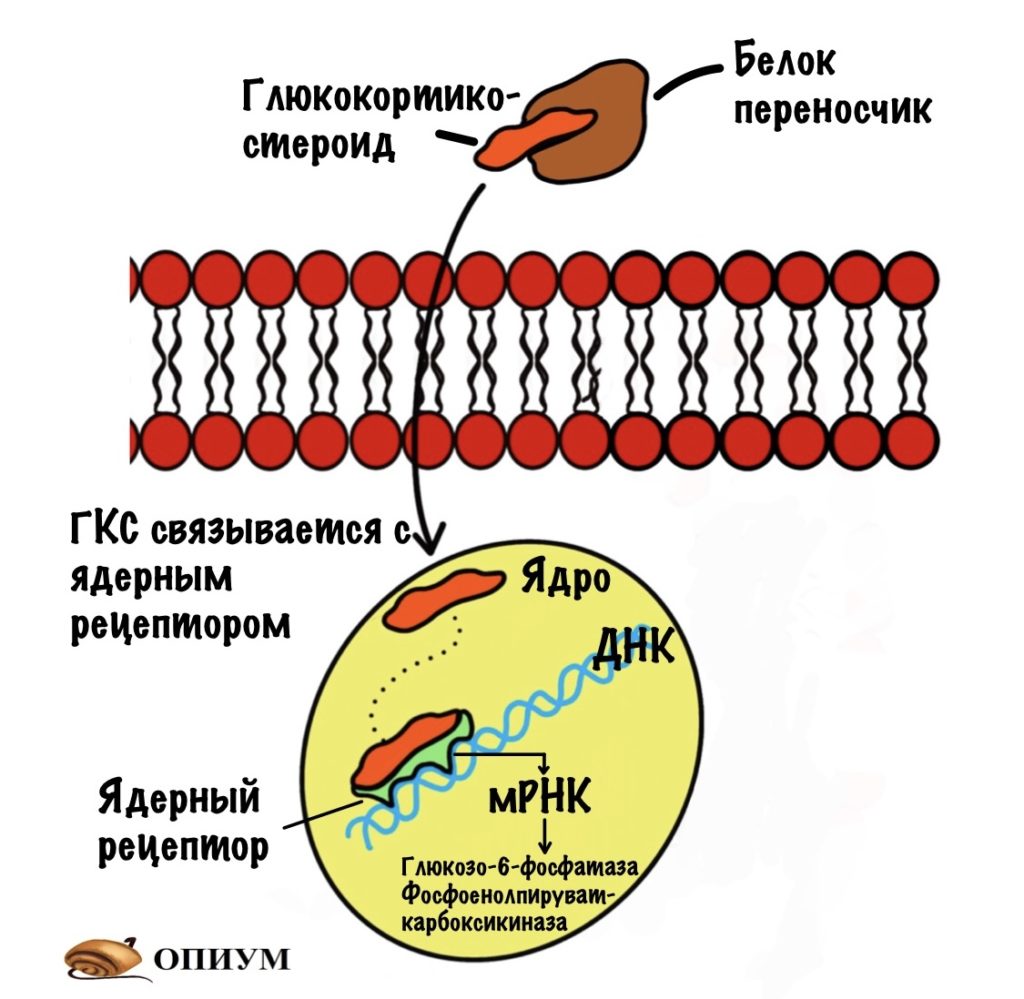
Глюкокортикостероиды
Это жирорастворимые молекулы. Из-за этого глюкокортикостероидам (ГКС) нужны белки-переносчики. А то они бы попадали в любую клетку, но нам нужно специфическое действие. Они циркулируют в крови, пока не попадут в нужную ткань, например в печень. После этого они проходят через клеточную мембрану, а оттуда в ядро. Там они связываются с ядерным рецептором. Это приводит к экспрессии генов, кодирующих глюкозо-6-фосфатазу и фосфоенолпируваткарбоксикиназу. Так что ГКС усиливают глюконеогенез.
Короче. Всё это конечно очень круто, но что нужно запомнить? Думаю, что достаточно такого: инсулин активирует факторы транскрипции ферментов гликолиза, глюкагон факторы транскрипции ферментов глюконеогенеза. Глюкокортикостероиды тоже активируют экспрессию синтеза ферментов глюконеогенеза, но через ядерные рецепторы. Если добавишь, что инсулин блокирует факторы транскрипции глюконеогенеза, то ты просто супер. А если вспомнишь про ксилулозо-5-фосфат и его влияние на гликолиз, то поздравляю — ты мега-мозг!